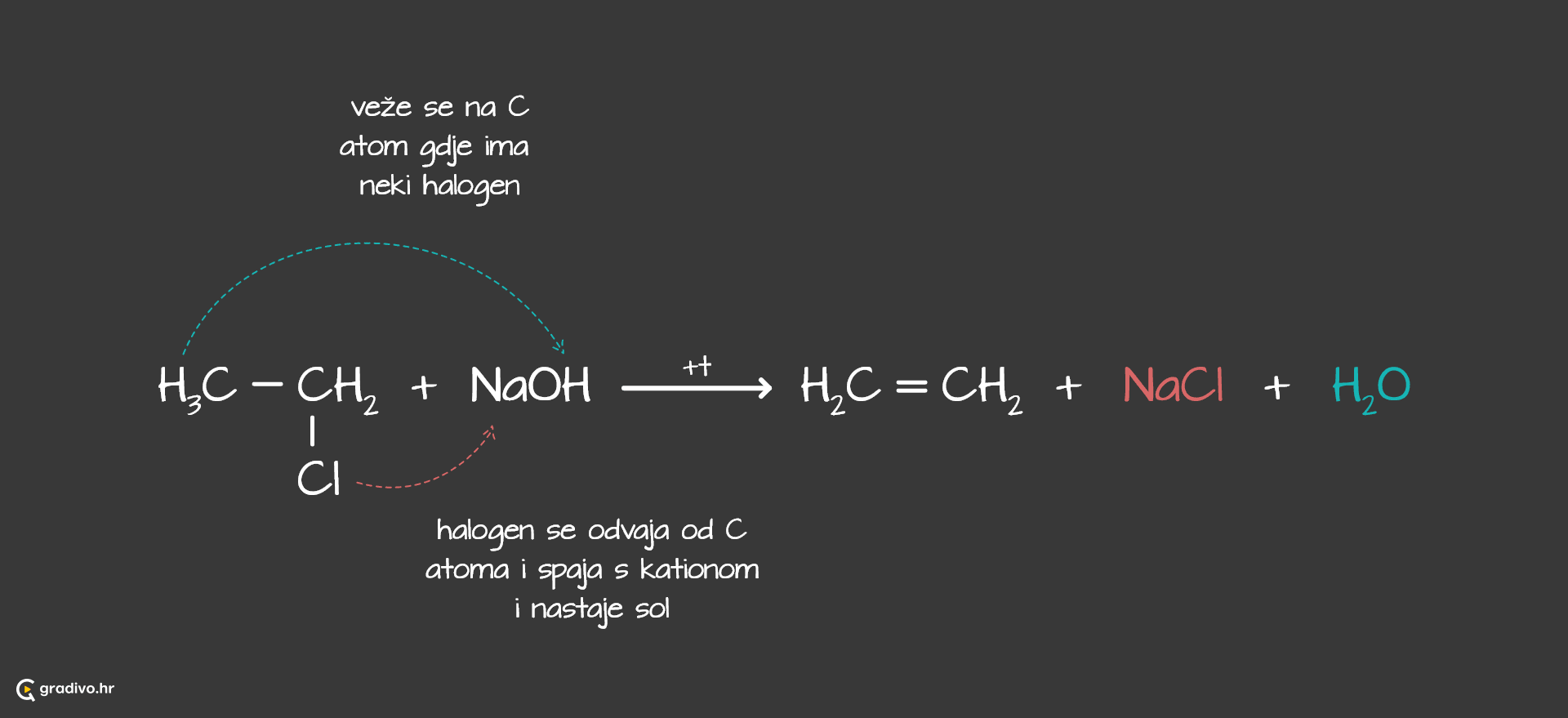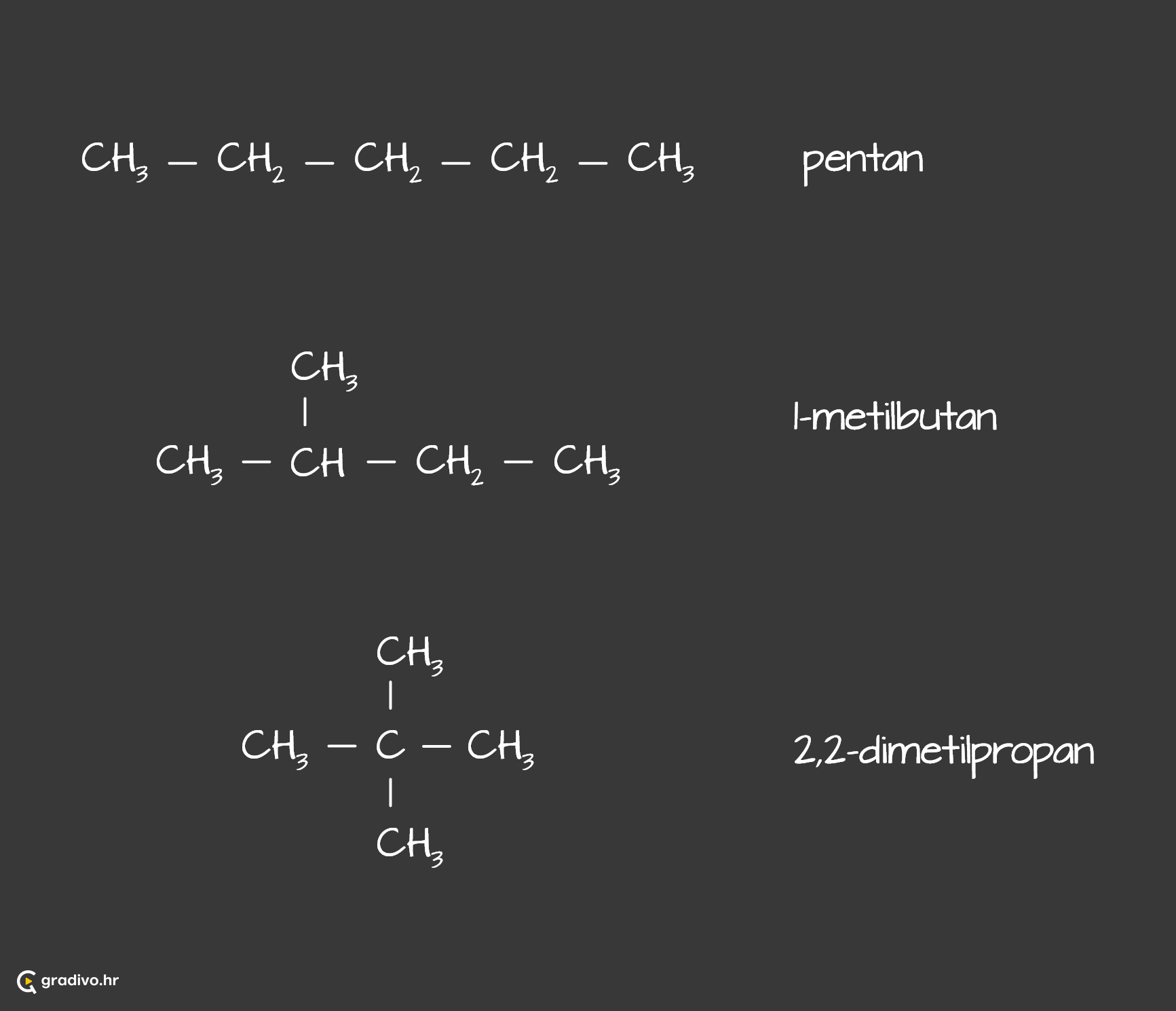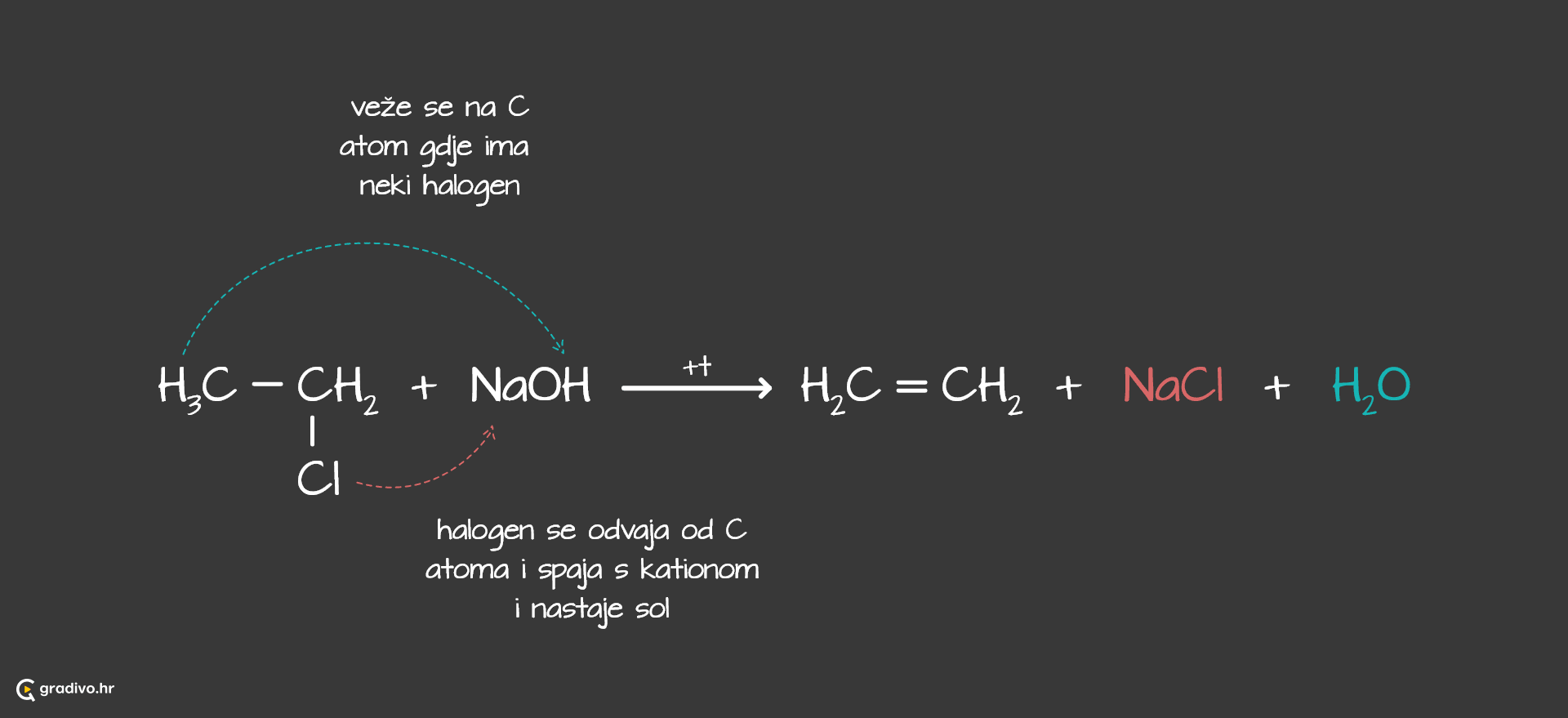Ugljikovodici su najjednostavniji organski spojevi, a sastoje se (kao što im i ime kaže) od ugljika i vodika. U organskim spojevima valencija ugljika je +IV što znači da ugljik oko sebe uvijek tvori četiri veze (pr. četiri jednostruke ili dvije dvostruke i sl.). Ugljikovi atomi mogu se povezivati jednostrukim, dvostrukim ili trostrukim vezama, a molekule ugljikovodika mogu biti ravnolančane ili cikličke.
Ugljikovodici se mogu podijeliti prema kemijskim svojstvina tj. prema zasićenosti na zasićene i nezasićene ugljikovodike. U zasićenim ugljikovodicima, ugljikovi atomi se međusobno povezuju jednostrukim vezama, dok se u u nezasićenim ugljikovodicima ugljikovi atomim osim jednostrukim vezama mogu povezivati višestrukim vezama. Zasićeni ugljikovodici su alkani (parafini) i cikloalkani (cikloparafini), a nezasićeni su alkeni (olefini), alkini (acetileni), cikloalkeni (cikloolefini) i aromatski ugljikovodici (areni).
Također, ugljikovodici se mogu podijeliti prema strukturnim osobitostima na lančaste (acikličke) i prstenaste (cikličke). U lančaste ugljikovodike ubrajaju se alkani, alkeni i alkini, dok se u cikličke ubrajaju cikloalkani, cikloalkeni i areni.
U molekulama ugljikovodika C atomi mogu biti vezani s više ugljikovih atoma (do četiri). Pa razlikujemo primarni C-atom (vezan sa samo jednim C-atomom), sekundarni (vezan sa dva susjedna C-atoma), tercijarni (vezan sa tri susjedna C-atoma) i kvaterni C-atom (vezan sa četiri susjedna C-atoma).


Ugljikovodike možemo prikazivati strukturnom formulom, sažetom strukturnom formulom, formulom s veznim crticama i molekulskom formulom, a načini prikazivanja prikazani su na primjeru butana. U strukturnoj formuli prikazuju se sve veze crticama, u sažetoj strukturnoj formuli ne pišemo crtice (osim kada prikazujemo vezu suspstituenta i glavnog lanca). U formuli s veznim crticama svaki vrh crtice označava po jedan ugljikov atom, a vodikove atome ne prikazujemo (iako su prisutni u molekuli).


Fizikalna svojstva zasićenih i nezasićenih ugljikovodika jako su slična.
Pri sobnoj temperaturi i normalnom tlaku, ugljikovodici koji imaju od 1 do 4 ugljikova atoma jesu plinovi, od 5 do 17 tekućine i od 18 pa nadalje krutine.
Povećanjem duljine ugljikovodičnog lanca rastu talište i vrelište zbog toga što se povećavaju dodirne površine molekula, što dovodi do jačih međumolekulskih (Londonovih) sila.
Razgranatiji ugljikovodici imaju niža tališta i vrelišta u odnosu na ravnolančaste zbog manjih dodirnih površina, što dovodi do slabijih Londonovih sila.
Ugljikovodici su netopljivi u vodi zbog svoje nepolarnosti. S druge strane, određeni halogenalkani su polarne molekule pa su i topljivi u vodi.
Ugljikovodici imaju manju gustoću od vode pa plutaju na njoj, dok halogenalkani imaju veću gustoću od vode te voda pluta na halogenalkanima.
Zasićeni ugljikovodici
Alkani
Glavni predstavnici zasićenih ugljikovodika su alkani. Alkani su skupina ugljikovodika koji između atoma ugljika imaju samo jednostruku vezu. Opća formula alkana je CnH2n+2.
gdje n označava broj ugljikovih atoma u molekuli.
Sustavno ime nerazgranatog alkana dobiva se na način da se korijenu imena dodaje nastavak –an. Prvih deset alkana čine homologni niz, a njihova imena nalaze se u sljedećoj tablici.
Ugljikovodici mogu imati i razgranate lance, gdje su na glavni lanac vezani supstituenti (gdje su supstituenti atom ili skupina atoma kojom je zamijenjen H atom u molekuli).
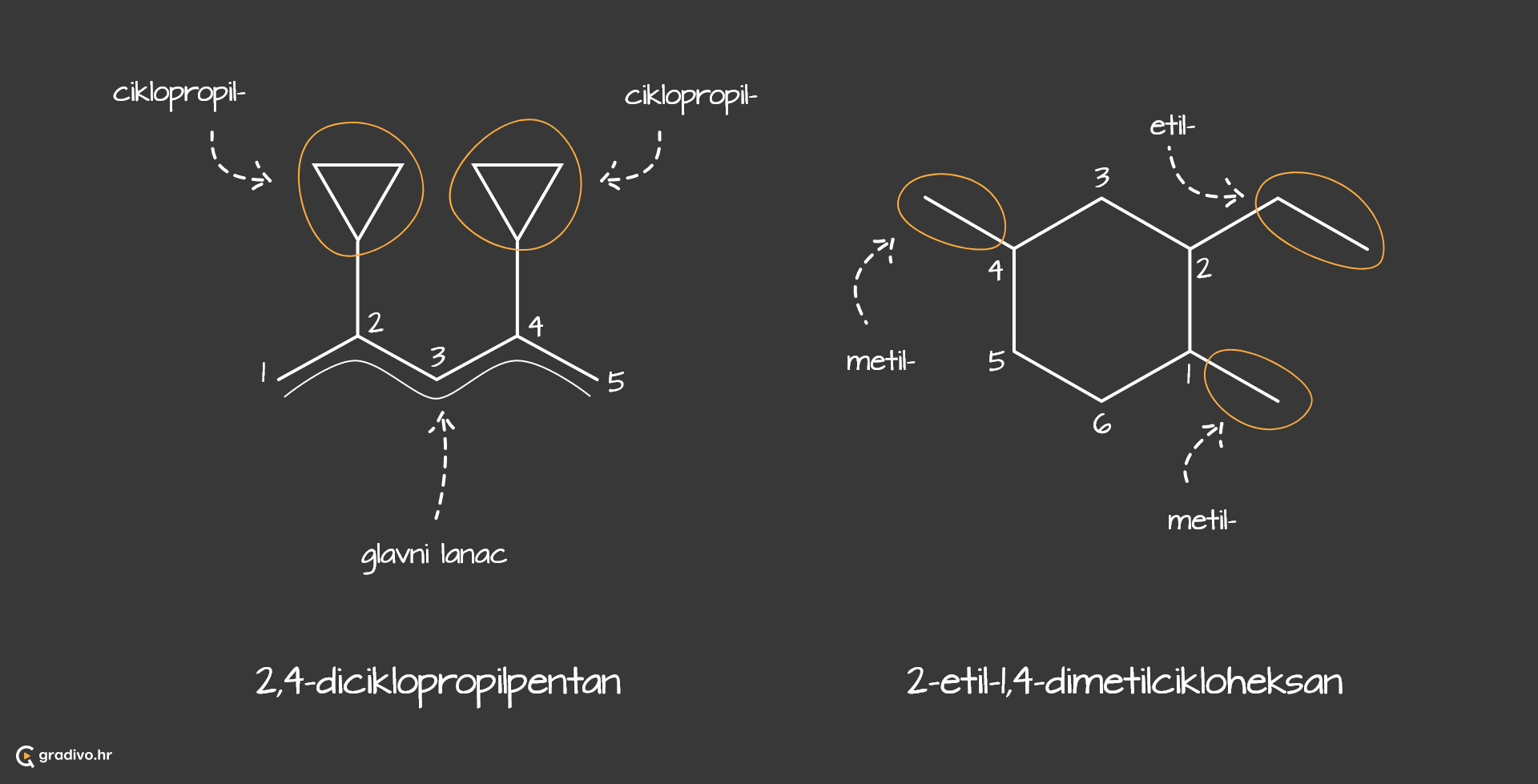
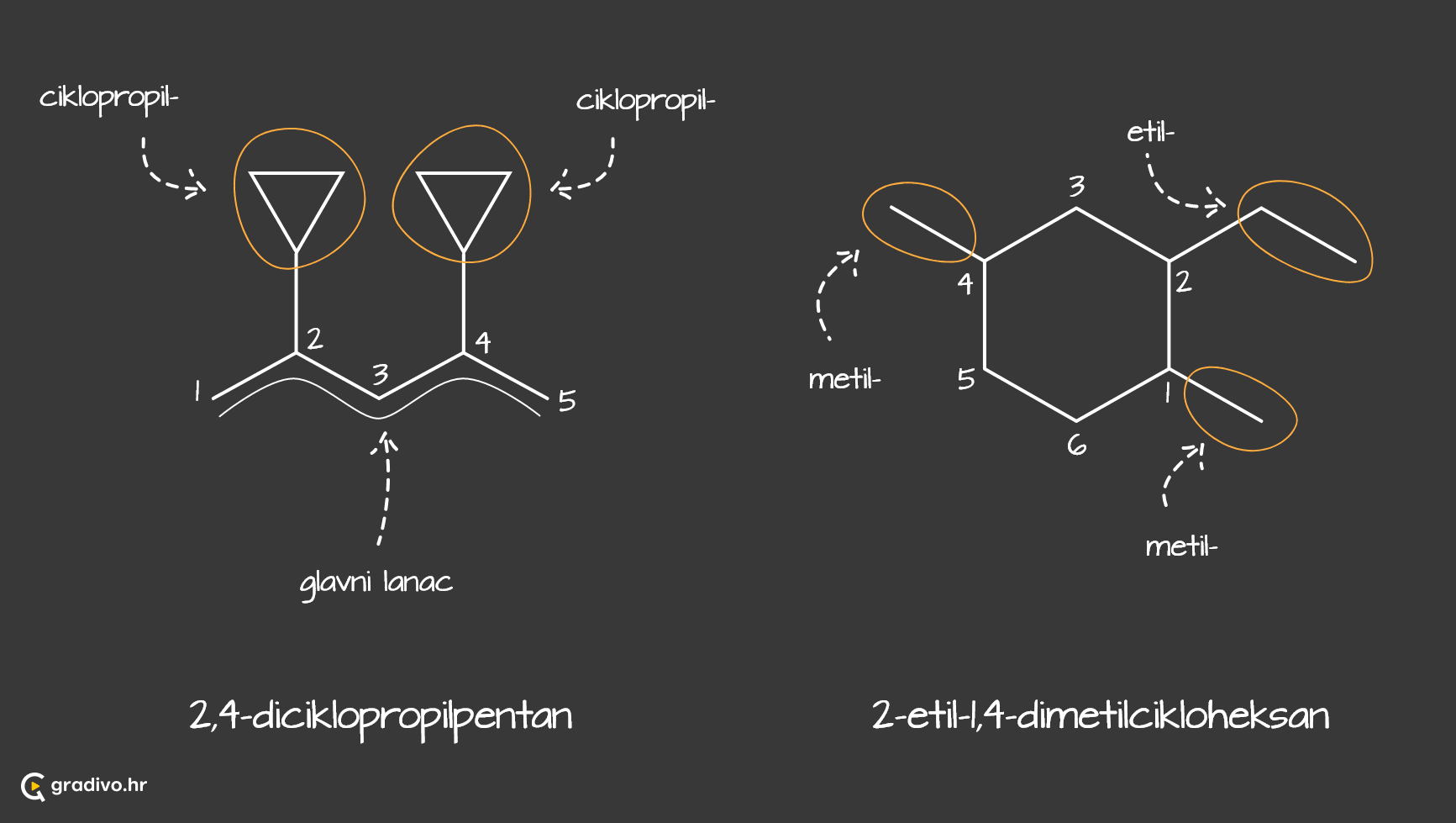
Za imenovanje razgranatih ugljikovodika postoje određena pravila koja je propisaio IUPAC (Međunarodna unija za čistu i primijenjenu kemiju), a objasnit ćemo ih na primjeru jednog ugljikovodika čiji prikaz veznim crticama izgleda ovako:


Postupak imenovanja ugljikovodika prati sljedeće korake:
1) odabire se najduži lanac ugljikovih atoma (glavni lanac) - ukoliko postoje dva lanca jednake duljine, odabire se onaj čiji su ogranci jednostavniji za imenovanje.
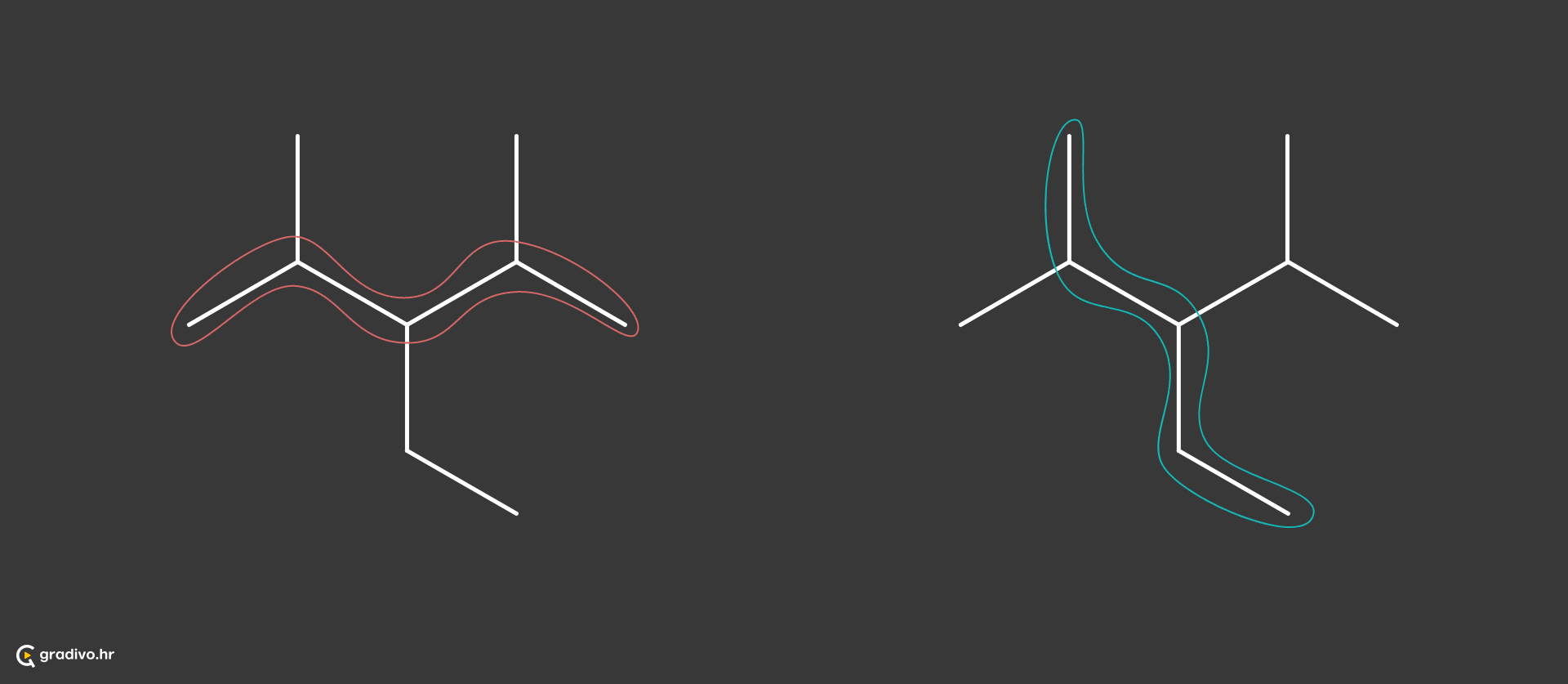

Tako je odabrani najdulji lanac prikazan crvenom bojom (lijevo), zato što je lakše imenovati njegove ogranke nego one na prikazu desno (plava boja).
2) određuje se položaj supstituenta na način da se ogranci nalaze na najnižem broju C atoma u molekuli.

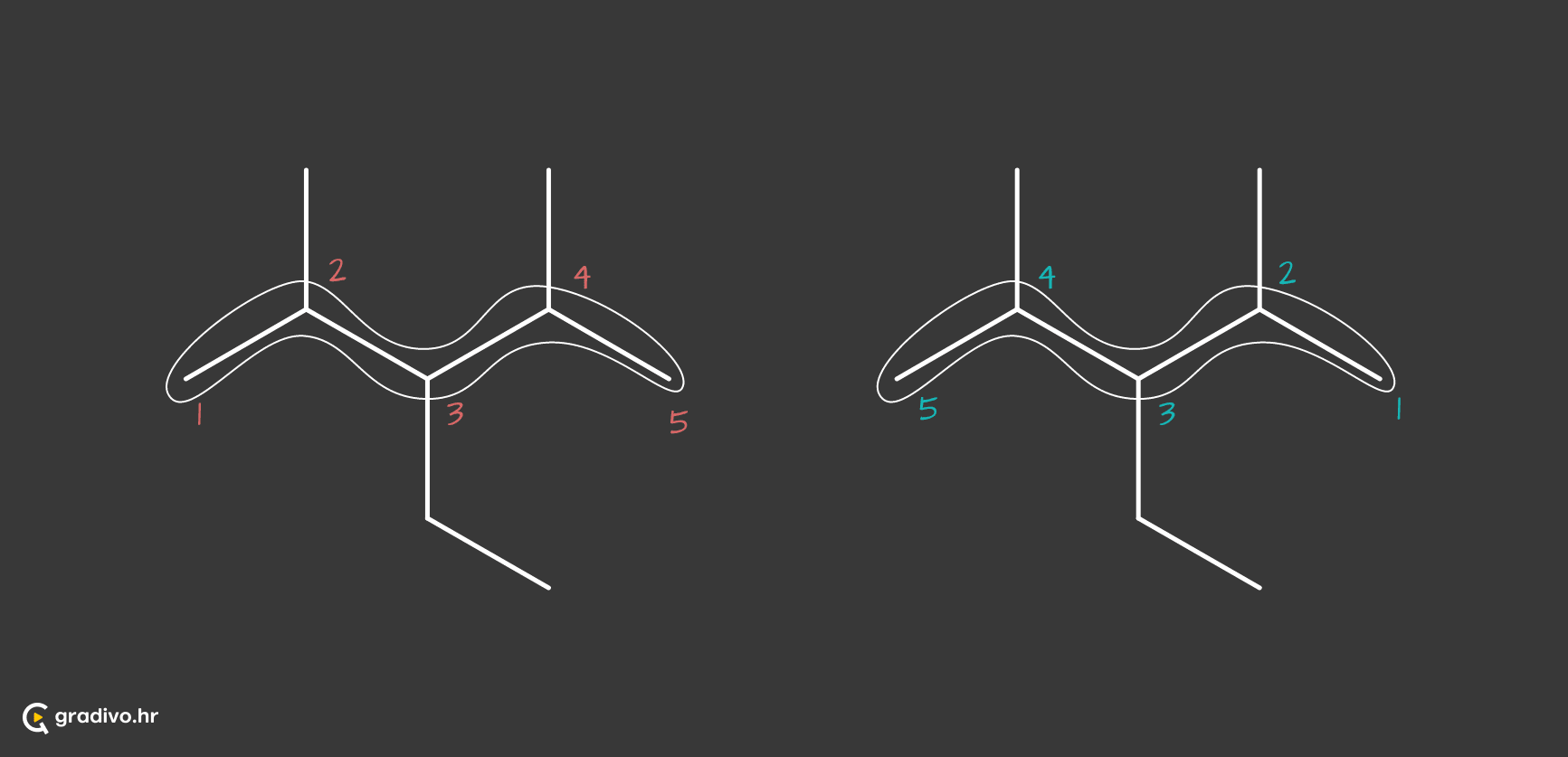
3) određuju se imena supstituenata na glavnom lancu - dobivaju nastavak -il.


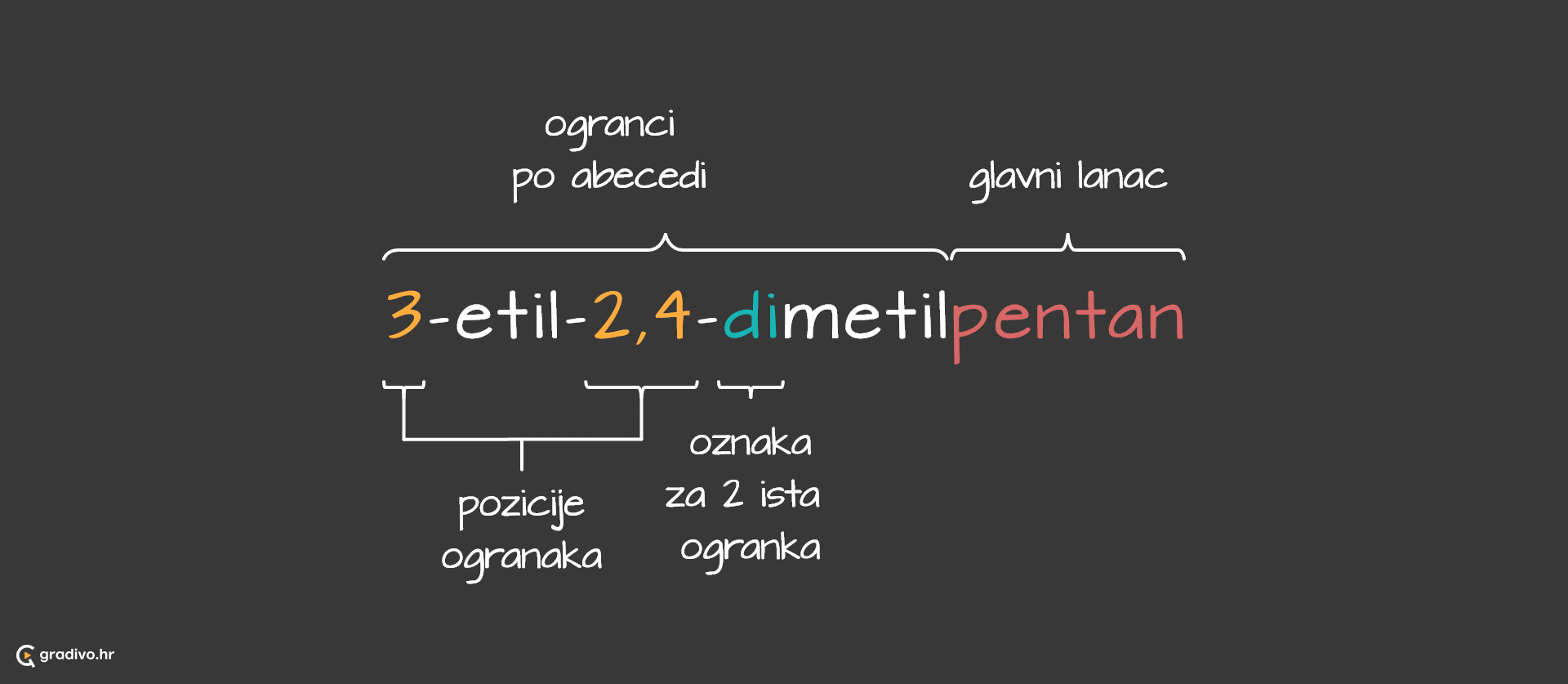
4) imenovati spoj.
Za početak navode se supstituenti ili ogranci abecednim redom. Prije no što se navede ime ogranka, navodi se broj ugljikova atoma na kojem se nalazi taj ogranak. Ukoliko postoji više istih supstituenata označavaju se prefiksima (di=dva, tri=tri, tetra=četiri...) koji ne ulaze u abecedni poredak. Na samom kraju, navodi se ime glavnog lanca.

Strukturni ili konstitucijski izomeri su spojevi iste molekulske formule, a različitog redoslijeda kovalentno vezanih ugljikovih atoma. Zbog različite strukture, molekule iste molekulske formule imaju različita svojstva.
Pr. Konstitucijskie izomere pentana dobijemo na način da „premještamo“ C-atome tako da broj C- i H-atoma ostane jednak.

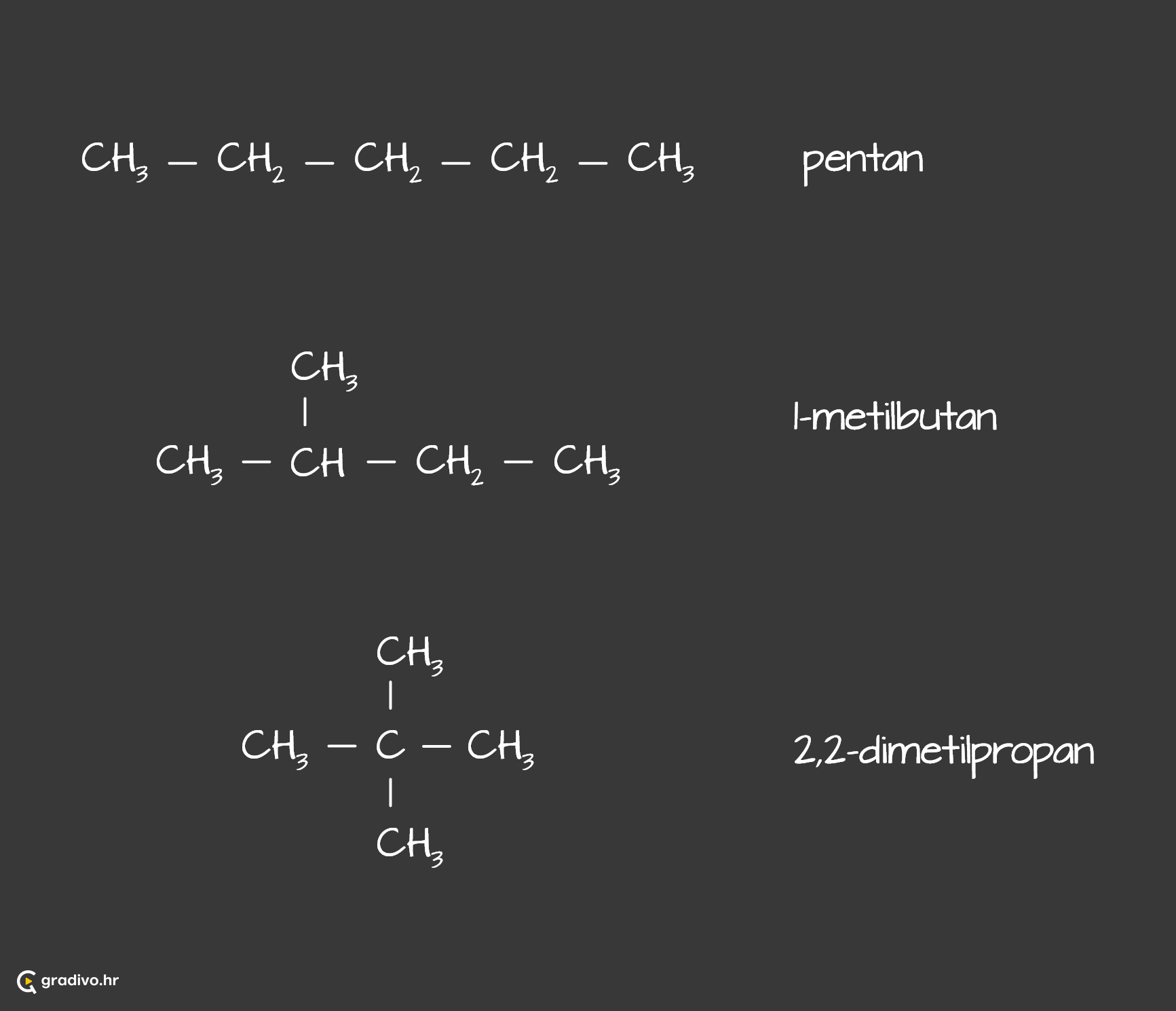
Karakteristične reakcije alkana su gorenje i supstitucija (zamjena).
Gorenje može biti potpuno ili nepotpuno. Kod potpunog gorenja, gorenje se odvija uz dovoljan pristup kisika i kao produkti uvijek nastaju CO2 i H2O. Kod nepotpunog gorenja, gorenje se odvija uz nedovoljan pristup kisika pa kao produkti uvijek nastaju CO i H2O.
Potpuno gorenje: C2H6 + 7/2 O2 ⟶ 2 CO2 + 3 H2O
Nepotpuno gorenje: C2H6 + 5/2 O2 ⟶ 2 CO + 3 H2O
Također, postoji i piroliza, odnosno analiza koja se provodi zagrijavanjem bez zraka u kojoj nastaju elementarni ugljik i vodik.
CH4(g) ⟶ C(s) + 2H2(g)
Supstitucija se kod alkana naziva još i halogeniranje jer u reakciji dolazi do zamjene jednog H atoma iz molekule s atomom halogenog elementa pri čemu nastaju halogenalkani (alkil-halogenidi). Takve reakcije su slobodnoradikalske (dolazi do stvaranja radikala) te se postižu uz zračenje.
CH4 + Cl2 ⟶ CH3Cl + HCl
CH3Cl + Cl2 ⟶ CH2Cl2 + HCl
CH2Cl2 + Cl2 ⟶ CHCl3 + HCl
CHCl3 + Cl2 ⟶ CCl4 + HCl
Cikloalkani
Cikloalkani su skupina zasićenih ugljikovodika u kojoj se ugljikovi atomi povezuju u prsten. Opća formula cikloalkana je CnH2n. Cikloalkani imenuju se tako da se alkanu s istim brojem C-atoma dodaje predmetak ciklo-.

Cikloalkan se smatra supstituentom ukoliko lanac na koji je vezan ima veći broj C-atoma od njega. Također, cikloalkan može biti i glavni lanac. Primjeri imenovanja cikloalkana, kada su oni ogranci i glavni lanci, prikazani su na sljedećoj slici.
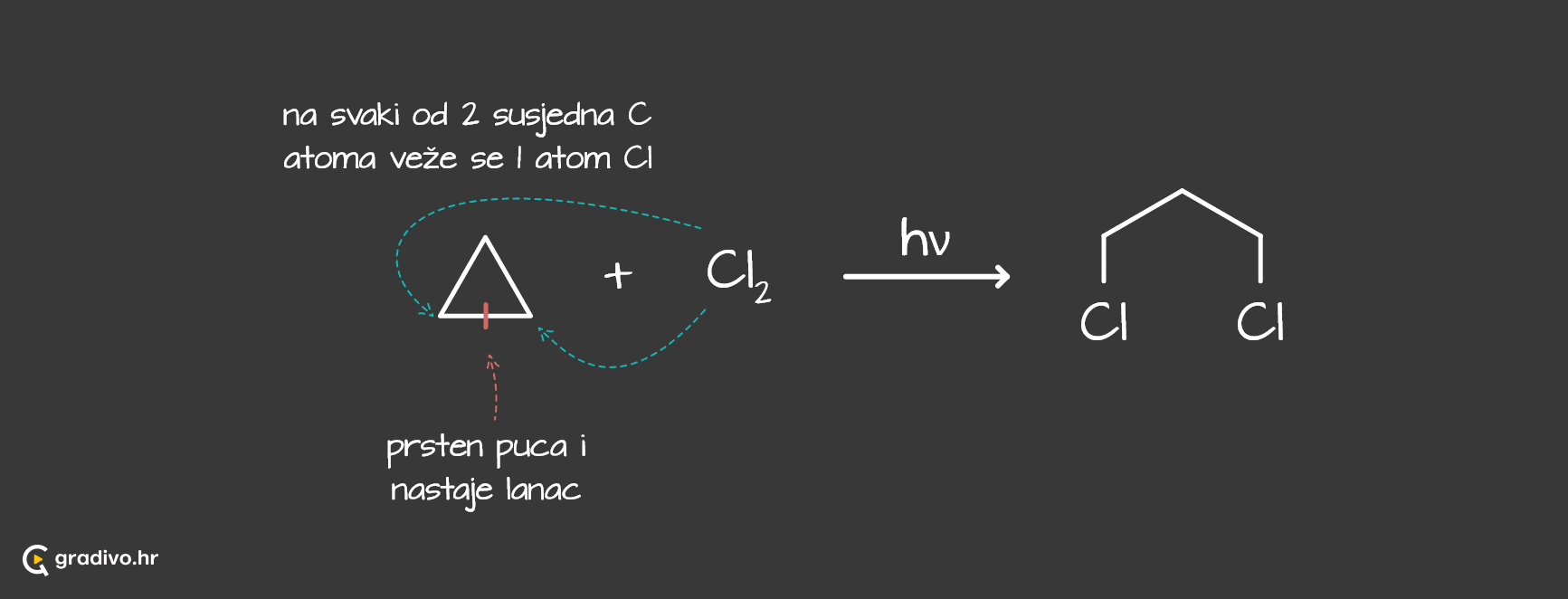
Kod prstena s tri i četiri C atoma karakteristične su radikalske reakcije adicije.



Kod onih cikloalkana s većim brojem C atoma od četiri, karakteristična je supstitucija.


Halogenalkani
Halogenalkani su alkani kojima je jedan ili više atoma ugljika zamijenjeno s halogenim elementima. Opća formula halogenalkana je R-X, gdje je X=F, Cl, Br... Prilikom imenovanja halogenalkana, halogeni element na glavnom lancu imenuje se kao supstituent.
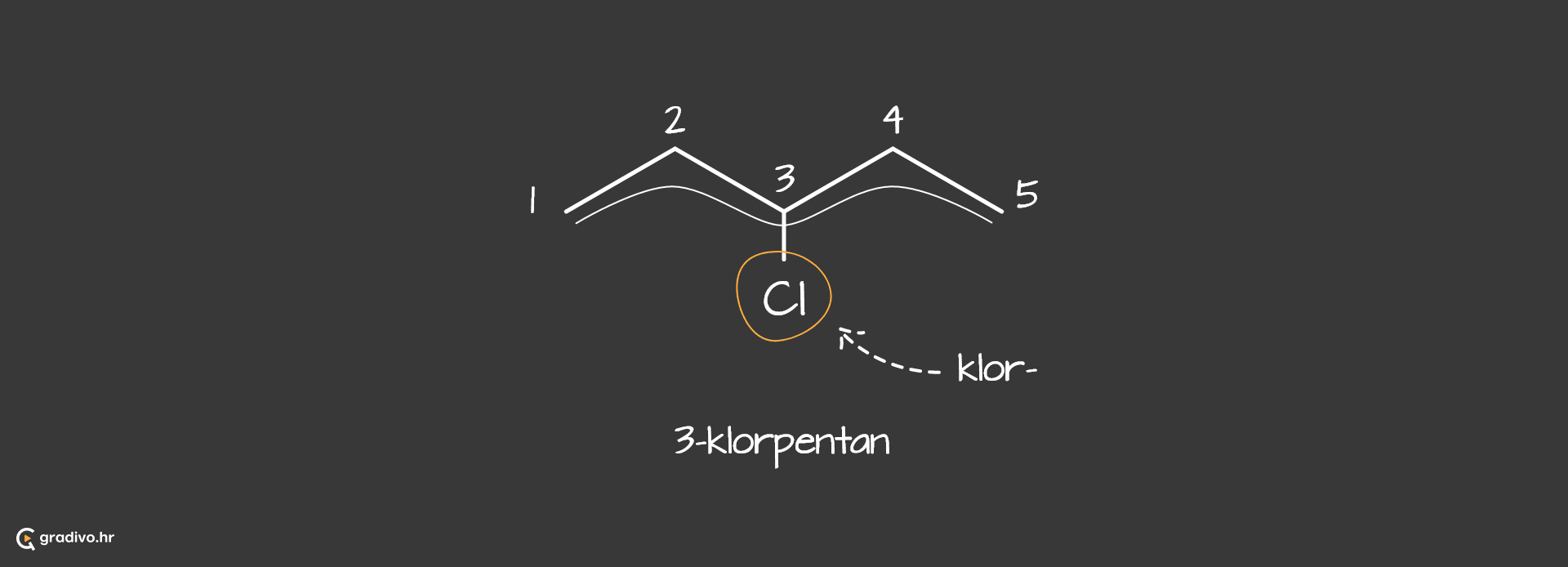
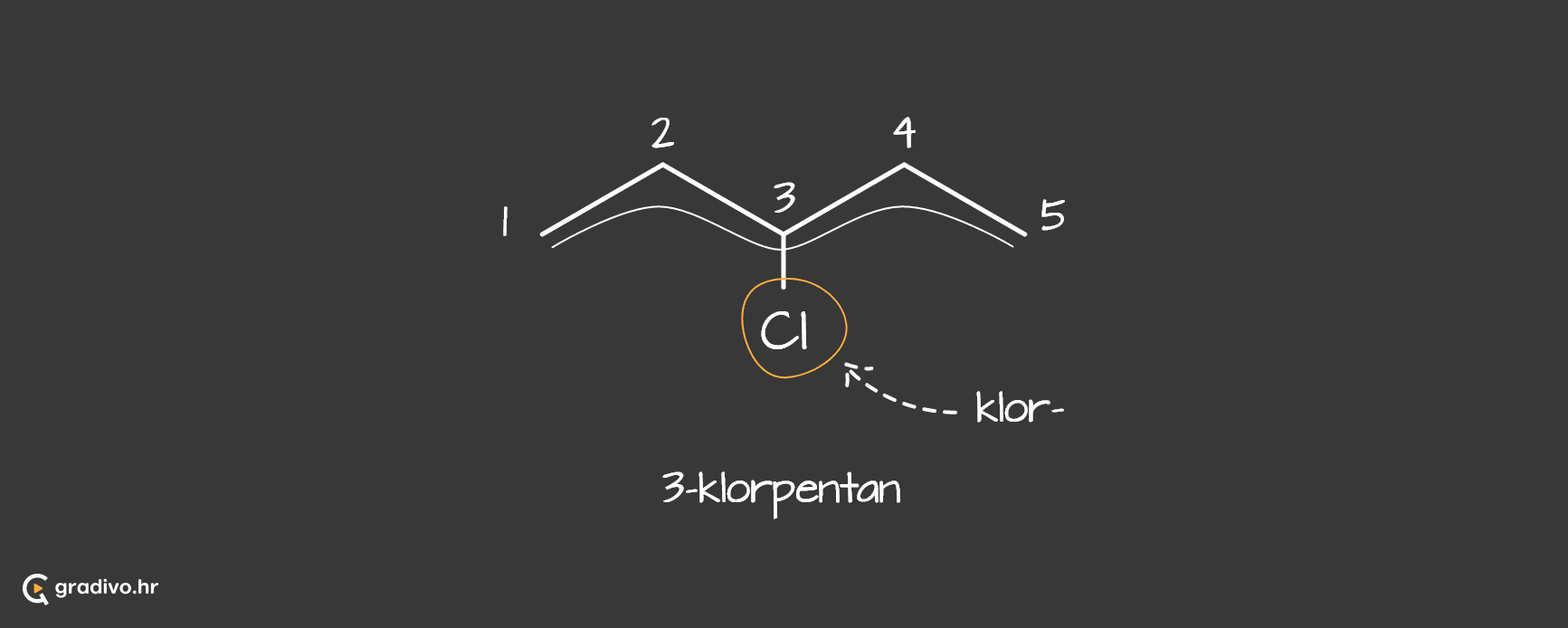
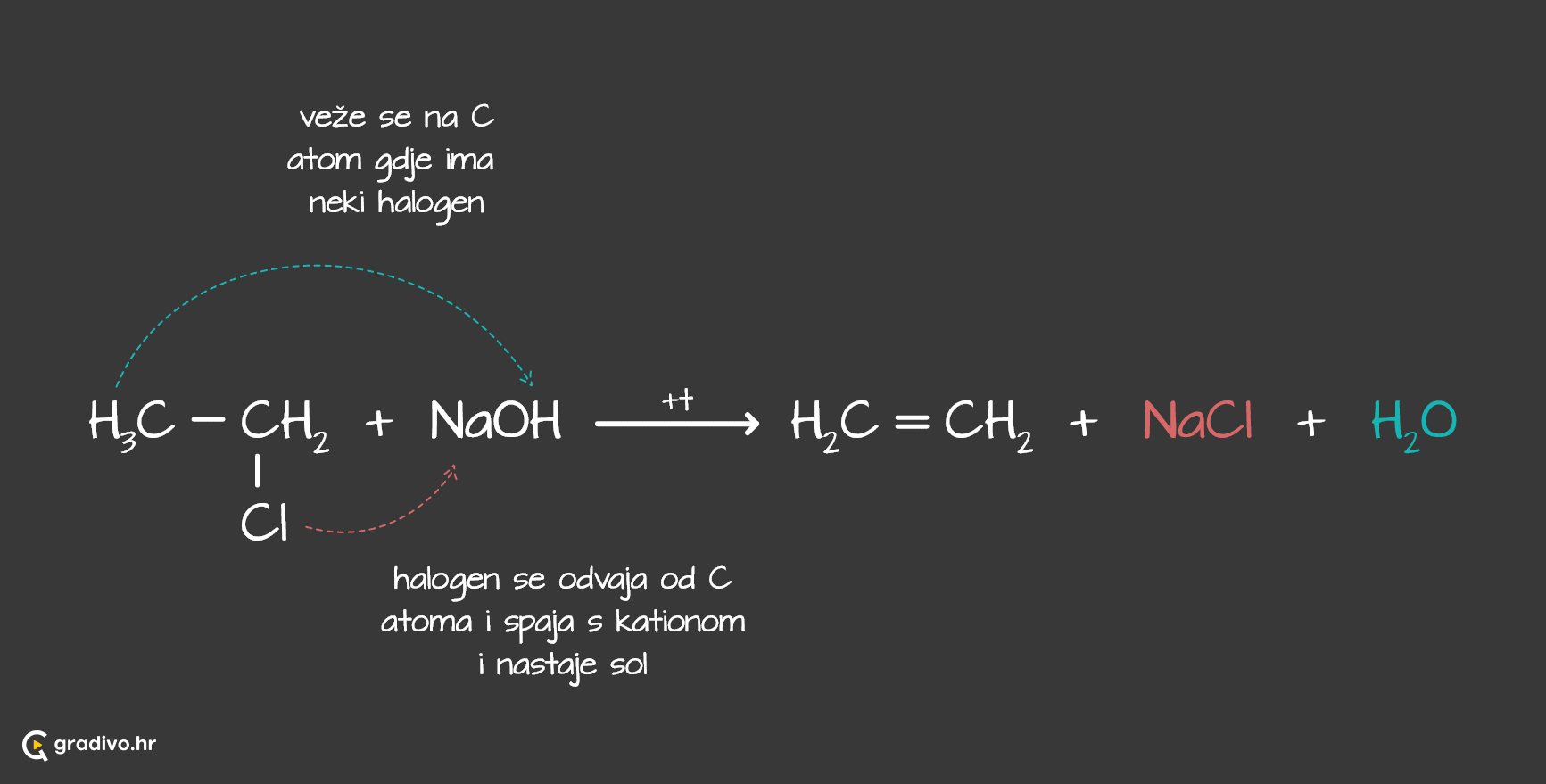
Karakteristične reakcije u kojima sudjeluju halogenalkani su supstitucija i eliminacija, koje su konkurentne reakcije.
U reakciji supstitucije, halogenalkani reagiraju s reagensima kao što je voda ili metalni hidroksidi pri čemu nastaju alkoholi.


U reakcijama eliminacije halogenalkani reagiraju u sličnim uvijetima kao kod supstitucije, a produkti su alkeni.