Izomeri su kemijski spojevi iste molekulske mase i formule. Međusobno se razlikuju prema rasporedu atoma unutar molekule pa ih tako možemo podijeliti u određene skupine.

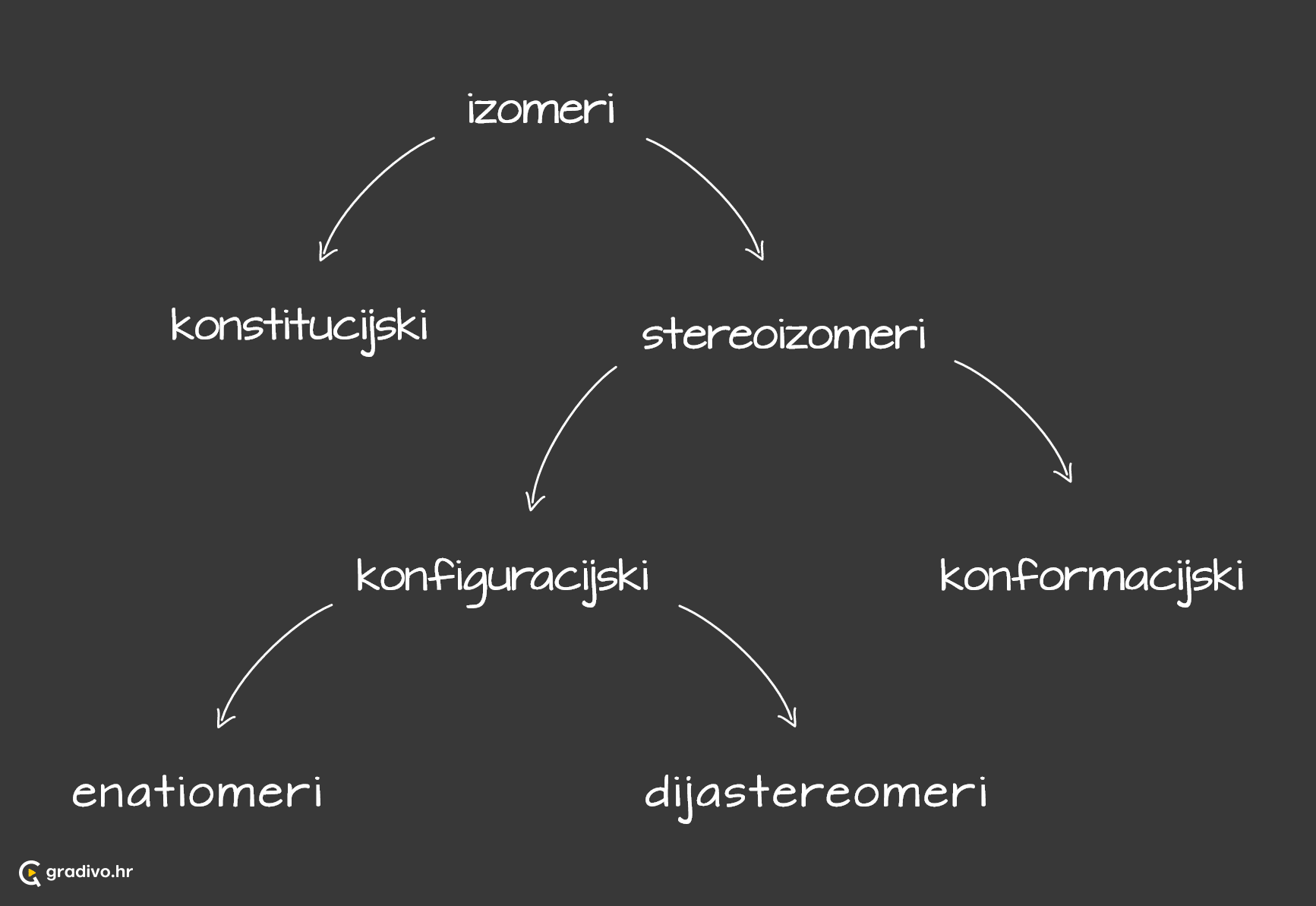
Kiralne molekule
Kiralne molekule ili enantiomeri (grč. enantios – nasuprot + meros – dio) spojevi su istih fizikalnih svojstava koje se ne razlikuju se po kemijskoj reaktivnosti (osim, primjerice, u enzimskim reakcijama). Otopine enantiomera su optički aktivne (njihove otopine istih koncentracija zakreću ravninu polarizirane svjetlosti u suprotnome smjeru, ali za isti iznos). Kiralne molekule ne mogu se preklopiti sa svojom zrcalnom slikom.
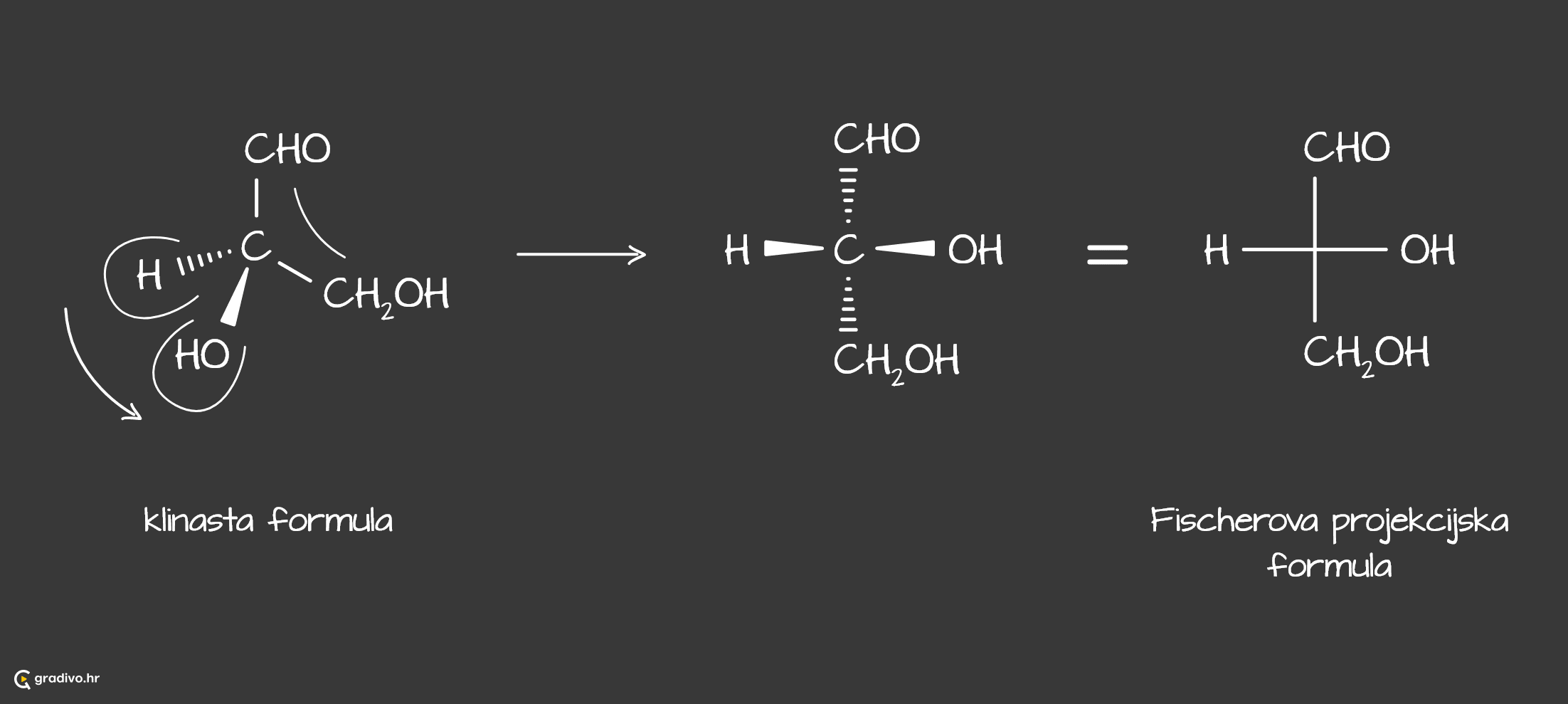
U prikazu kiralnih molekula, bitno je naglasiti gdje se nalaze pojedini atomi ili skupine atoma u prostoru. Tada se uvode klinaste strukturne oznake - one koje pokazuju da se atom ili skupina atoma nalaze u ravnini papira, iznad ravnine papira ili ispod ravnine papira.


Klinastim strukturnim formula možemo prikazati i molekulu gliceraldehida. Na središnji atom ugljika vezane su četiri različite skupine: vodikov atom (H), hidroksimetilna skupina (CH2OH), hidroksilna skupina (OH) i aldehidna skupina (CHO).


Molekula gliceraldehida jest kiralna zato što se njena zrcalna slika ne poklapa sa stvarnom slikom.


Ukoliko je ugljikov atom okružen s 4 različita atoma ili skupine, tada je ta molekula kiralna te se takav ugljikov atom naziva asimetrično supstituirani ugljikov atom ili kiralni ugljikov atom. Označava se zvjezdicom (*). Molekula nema nijednu ravnine simetrije koja bi ju podijelila na dva zrcalno jednaka dijela i upravo zbog toga je asimetrični ugljikov atom središte te asimetrije. Kiralnost molekula koje sadržavaju jedan ili više asimetričnih ugljikovih atoma posljedica je odsutnosti bilo kakvih elemenata simetrije u njima.
Ukoliko molekula ima kiralni ugljikov atom, tada ona posjeduje određeni broj stereoizomera. Ukupan broj stereoizomera može se izračunati prema formuli 2n, gdje je n broj kiralnih centara.
Za prikaz kiralnih molekula koriste se i Fischerove projekcijske formule. One su pogodne za prikazivanje molekula s dvama ili više asimetričnih ugljikovih atoma. U njima asimetrični ugljikov atom nalazi se na presjecištu i ne obilježava se kemijskim simbolom, a na veznim se crticama prikazuju preostala četiri supstituenta.
Iz klinastog prikaza lako je nacrtati Fischerovu projekcijsku formulu pomoću modela "leptira".
U klinastom prikazu, skupine koje se nalaze na ravnini papira će se u Fischerovoj projekcijskoj formuli nalaziti na okomitoj liniji.
Skupine koje se nalaze ispod i iznad ravnine papira predstavljaju "krila leptira" i kada se "ta krila otvore" tako će se i skupine nalaziti na vodoranoj liniji Fischerove formule.

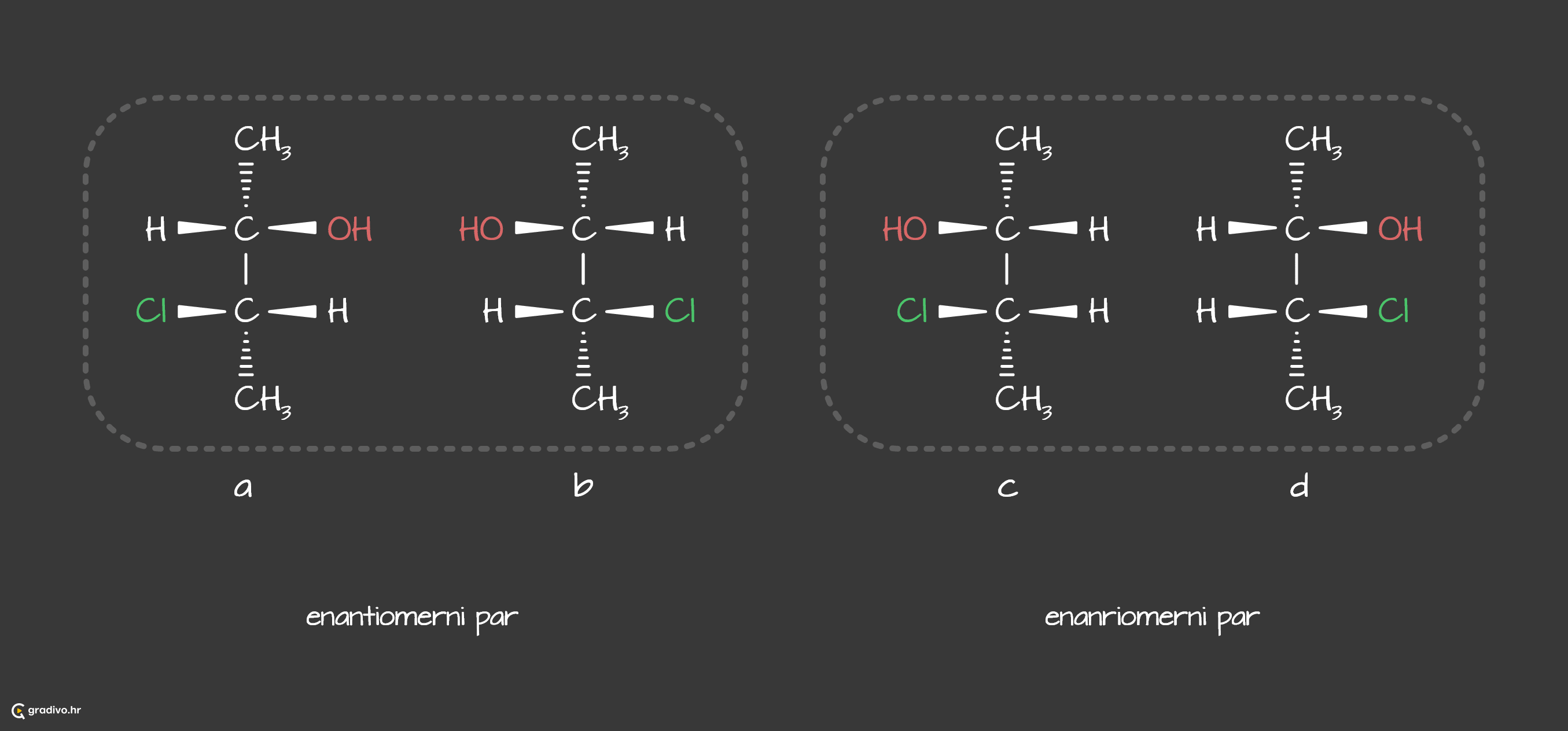
Spomenuli smo da se kiralne zrcalno simetrične molekule nazivaju enantiomeri. Ukoliko molekule imaju isti molekulsku formulu, vrlo slično izgledaju (imaju iste skupine), ali nemaju zrcalnu simetriju međusobno, tada se one nazivaju dijastereomeri ili dijastereoizomeri.
Na sljedećem prikazu, enantiomerni parovi su a. i b., ali i c. i d.. S druge strane, dijastereomeri su a. i c., a. i d., b. i c., b. i d.

Apsolutna konfiguracija
Apsolutna konfiguracija određuje se tako da se asimetričnom ugljikovu atomu, u skladu s dogovorenim pravilima, pripišu konfiguracijske oznake R ili S (lat. rectus – desno, sinister – lijevo). Određivanje apsolutne konfiguracije provodi se kroz nekoliko koraka.
Za početak, potrebno je pronaći asimetrični ugljikov atom te odrediti prednosti (prioritete) supstituenata vezanih za asimetrični ugljikov atom (atomu s najvećim protonskim brojem pripisuje prioritet 1, a s najmanjim 4).

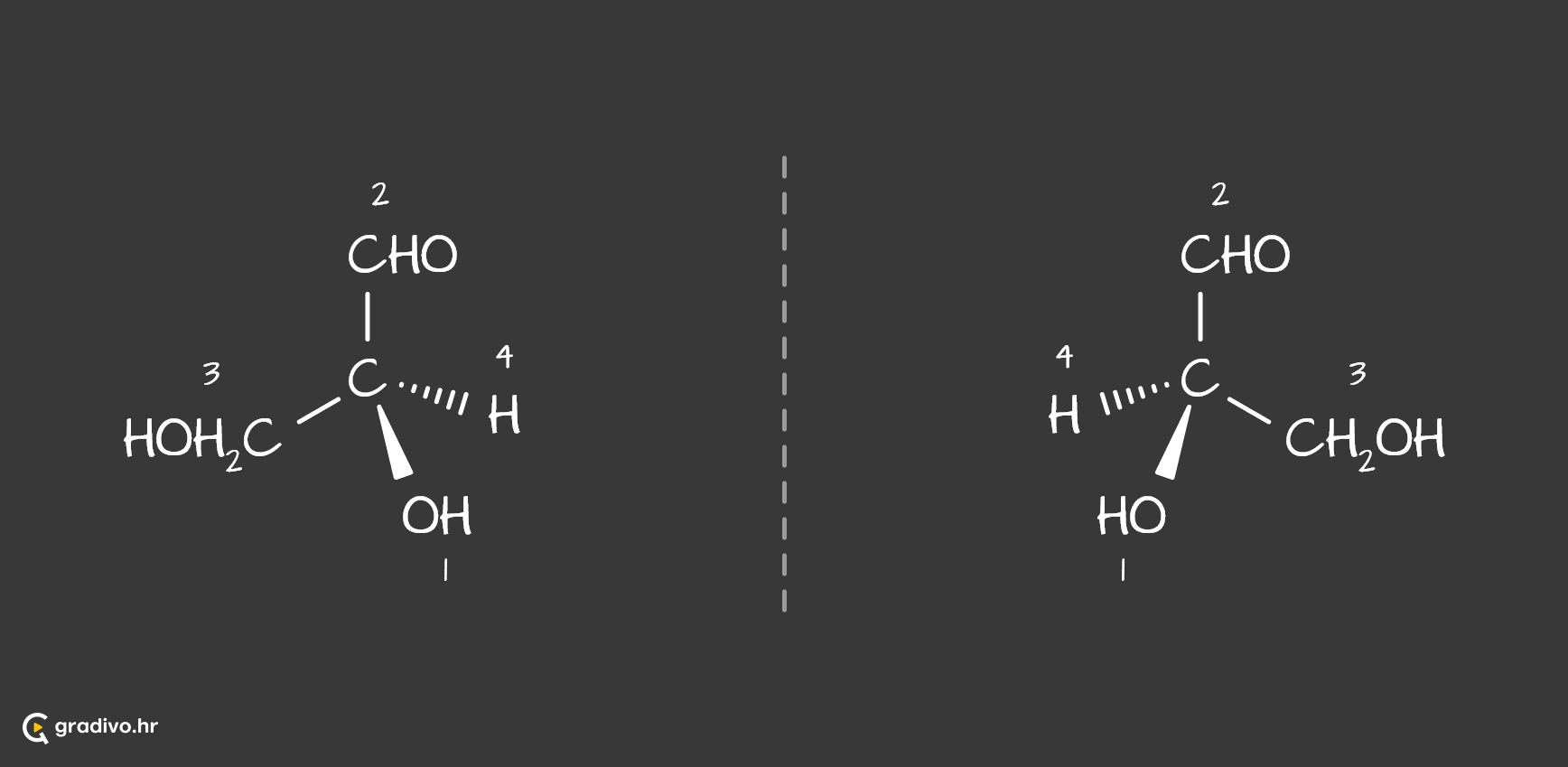
Molekula prikazana klinastom formulom promatra se kroz asimetrični ugljikov atom u smjeru skupine najniže prednosti tj. gledamo molekulu tako da se atom ili skupina atoma označena brojem 4 nalazi iza asimetričnog ugljikovog atoma.
Potom se promatra smijer okreta. Promatra se u kojem smijeru se kreću brojevi 1, 2 i 3.
Ukoliko se oni kreću u smjeru kazaljke na satu, tada je apsolutna konfiguracija R.

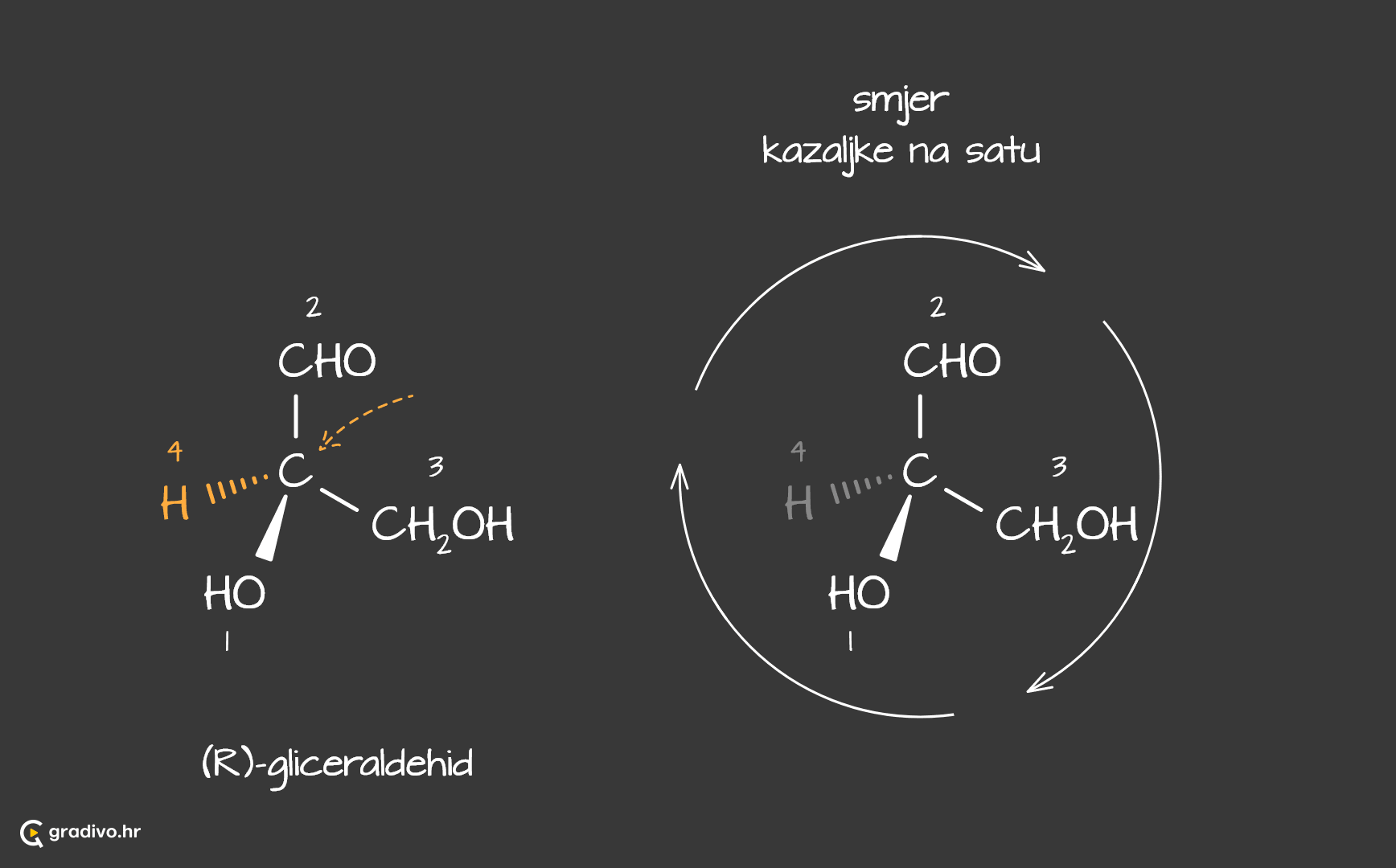
Ukoliko se oni kreću suptorno smjeru kazaljke na satu, tada je apsolutna konfiguracija S.


Relativna konfiguracija
Relativna konfiguracija je eksperimentalno utvrđeni odnos između konfiguracija dviju kiralnih molekula bez poznavanja njihovih apsolutnih konfiguracija. Jedna od molekula jest ona kojoj se određuje konfiguracija, dok je druga molekula standard za usporedbu. Prema dogovoru standard je prirodni (+)-gliceraldehid kojemu je proizvoljno pripisana oznaka relativne konfiguracije D, dakle D-(+)-gliceraldehid. D i L stariji su način obilježavanja konfiguracije na asimetričnom ugljikovu atomu te se koriste za označavanje kiralnih prirodnih spojeva (primjerice, šećeri i aminokiseline).

















