Karboksilne kiseline
Organske kiseline su organski spojevi koji imaju kisela svojstva. Najčešće među njima su
Karboksilne kiseline sadrže jednu ili više
Atom ugljika karboksilne skupine s jednim je atomom kisika povezan dvostrukom vezom, dok je s atomom kisika hidroksilne skupine i atomom ugljika ugljikovodičnog lanca ili prstena, odnosno atomom vodika kod metanske kiseline, povezan dvjema jednostrukim vezama.

Karbiksilne kiseline dijele se prema prema broju hidroksilnih skupina na
Alifatske acikličke karboksilne kiseline sustavno se imenuju tako da se imenu osnovnog ugljikovodika na koji je vezana karboksilna skupina doda nastavak –ska kiselina.

Karboksilna skupina uvijek je na početku ugljikovodičnog lanca i numeriranje najduljeg lanca počinje od nje.
Homologni niz monokarboksilnih alifatskih kiselina prikazan je u tablici.
metanska (mravlja) kiselina
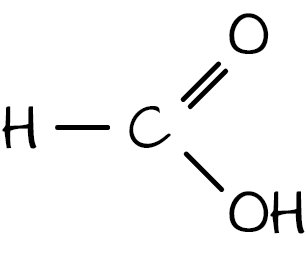
metanoat (formijat)
etanska (octena) kiselina
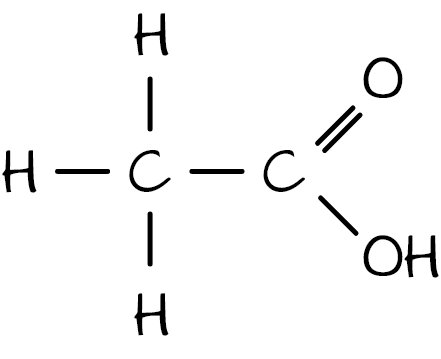
etanoat (acetat)
propanska (propionska) kiselina
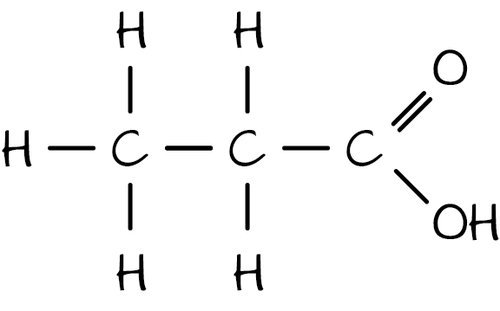
propanoat (propionat)
butanska (maslačna) kiselina
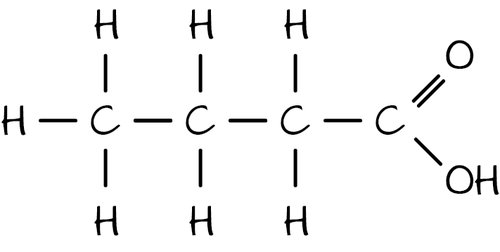
butanoat (butirat)
Karboksilne kiseline s većim brojem atoma ugljika u lancu (uglavnom od 12 do 22) nazivaju se
Monokarboksilne kiseline u čijim je molekulama karboksilna skupina neposredno vezana na ciklički ugljikovodik, alifatski ili aromatski, imenuju se tako da se imenu cikličkog ugljikovodika doda nastavak –karboksilna kiselina.

Dikarboksilne kiseline sadržavaju samo dvije karboksilne skupine.

Karboksilne kiseline dijele se i prema supstituentima glavnog ugljikovodičnog lanca. Pa tako, ukoliko je hidroksilna skupina supstituent glavnog ugljikovodičnog lanca, ona se naziva hidroksikarboksilne kiseline. Njezin položaj na lancu označava brojem ispred odgovarajućeg prefiksa.
Međumolekulske interakcije
Glavne međumolekulske interakcije između molekula karboksilnih kiselina jesu

Također, karboksilne kiseline tvore vodikove veze s molekulama vode.

Fizikalna svojstva karboksilnih kiselina
Karboksilne kiseline imaju
Kiseline s kraćim lancem dobro su topljive u vodi, vežu se vodikovim vezama. Kiseline s duljim lancem netopljive su u vodi jer se smanjuje utjecaj polarnog karaktera karboksilne skupine.
Kemijska svojstva karboksilnih kiselina
Vodikov atom, sastavni je dio karboksilne skupine, odgovoran je za

Karboksilne se kiseline u reakciji s metalima i bazama (bazični oksidi ili hidroksidi) daju soli – karboksilate.
U reakciji karboksilne kiseline i metala nastaju sol i vodik.
2CH3COOH(aq) + 2K(s) → H2(g) + 2CH3COOK(aq) (sol se zove kalijev etanoat ili kalijev acetat)
U reakciji karboksilne kiseline i oksida metala nastaju sol i voda.
2HCOOH(aq) + MgO(s) → H2O(l) + (HCOO)2Mg(aq) (sol se zove magnezijev metanoat ili magnezijev formijat)
U reakciji karboksilne kiseline i lužine nastaju sol i voda.
2HCOOH(aq) + Ca(OH)2(s) → 2H2O(l) + (HCOO)2Ca(aq) (sol se zove kalcijev metanoat ili kalcijev formijat)
Monokarboksilne kiseline moguće je pripraviti

Octena kiselina u prirodi nastaje procesom
Derivati karboksilnih kiselina
Ukoliko se hidroksilna skupina karboksilne skupine zamijeni nekom drugom skupinom, tada više nemamo karboksilnu kiselinu, već derivat karboksilne kiseline. Postoji nekoliko takvih derivata.

Esteri

Uz estere, i one prirodne, i one pripravljene u laboratoriju, uglavnom se vezuju mirisna svojstva. Mirisi nekih vrsta voća i cvijeća određeni su pristutnošću estera koji, u smjesi s ostalim sastojcima, daju miris prirodnom materijalu. Brojni sintetski esteri uporabljuju se kao arome u prehrambenoj industriji i kozmetici. Ipak, najveću skupinu prirodnih estera čine trigliceridi, esteri koje nalazimo u sastavu različitih masti i ulja.
Ime estera sastoji se od dva dijela.
Prvo se imenuje dio koji je pripadao alkoholu, tj. alkilna skupina (metil-, etil-, butil-, propil- itd.), a zatim se dodjeljuje ime koje pripada karboksilnoj kiselini tj. karboksilatu (metanoat, etanoat, propanoat...). Oba dijela imena odvajaju se crticom.

Fizikalna svojstva estera
Esteri
Esteri su
Imaju
Kemijska svojstva estera
Esteri se mogu dobiti reakcijom alkohola i karboksilne kiseline, u prisutnosti kiselog katalizatora, najčešće sumporne kiseline. Ta se kemijska reakcija zove
Priprava estera iz karboksilnih kiselina i alkohola je supstitucijska reakcija u kojoj se hidroksilna skupina molekule karboksilne kiseline zamjenjuje alkoksidnom (–OR).


Reakcija suprotna esterifikaciji zove se
Hidroliza estera može teći i u kiselim i u baznim uvjetima.
Kiselom hidrolizom estera nastaju karboksilna kiselina i alkohol.

Kod hidrolize estera u baznim uvjetima baza služi kao reaktant.

Kao uobičajene baze koriste se natrijeva i kalijeva lužina. Hidroliza u baznim uvjetima nepovratan je proces. Bazna hidroliza estera naziva se i
Postupak proizvodnje sapuna poznat je od davnina jer su još stari narodi zagrijavanjem životinjskih masti pomiješanih s pepelom dobivali sapune.
Baznom hidrolizom masti i ulja nastaju soli masnih kiselina – sapuni.

Isprobaj potpuno besplatno!
Registracijom dobivaš besplatan*
pristup dijelu lekcija za svaki predmet.















