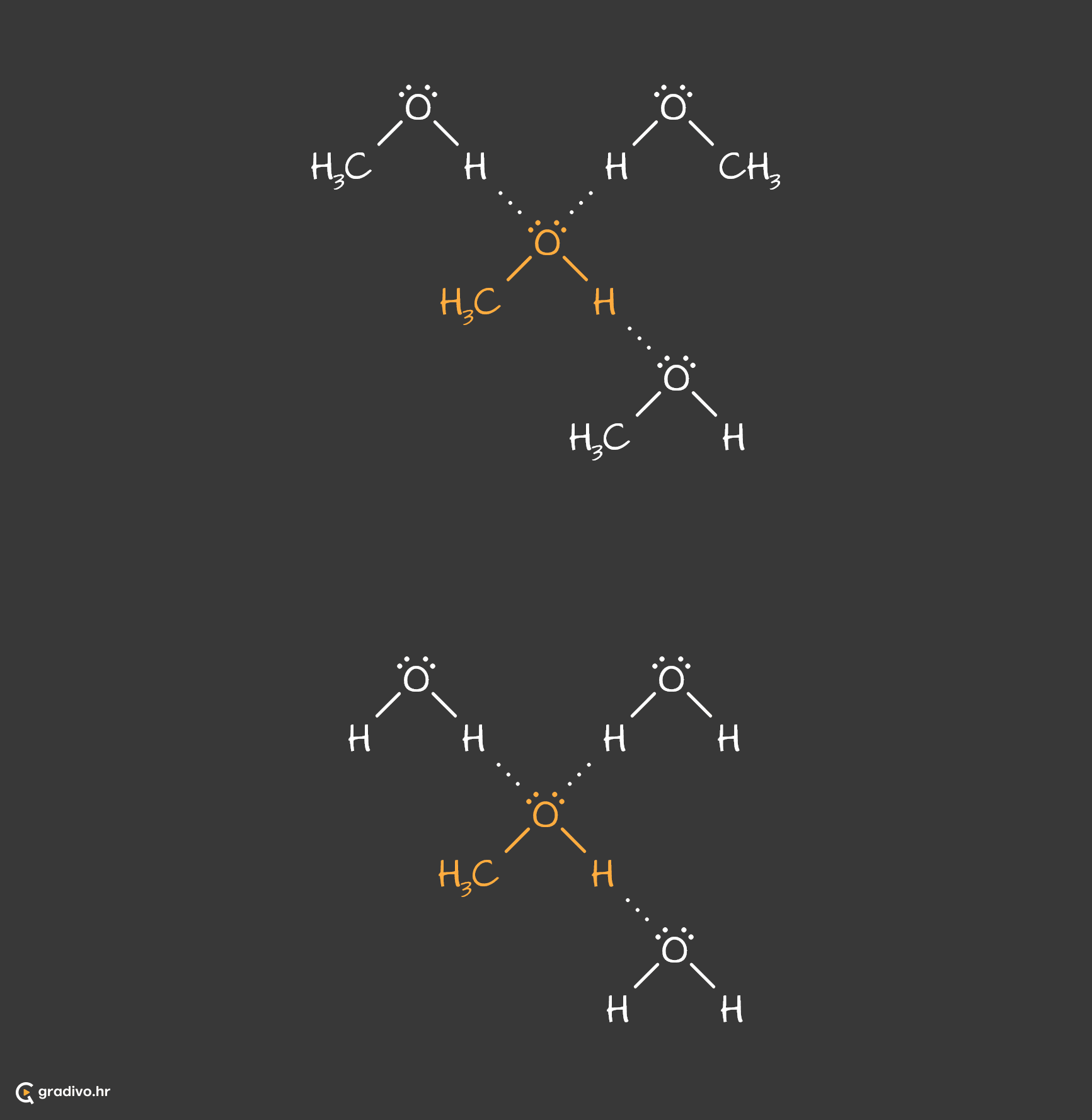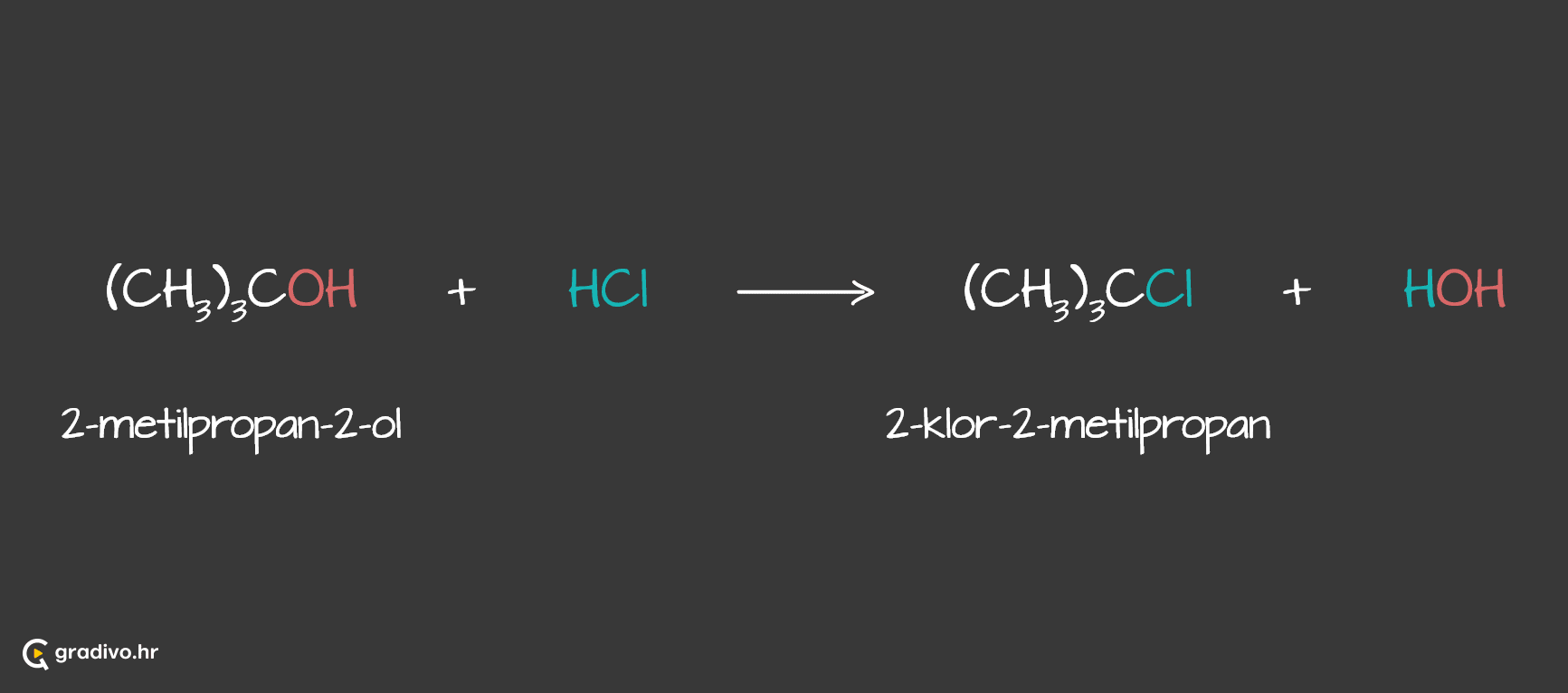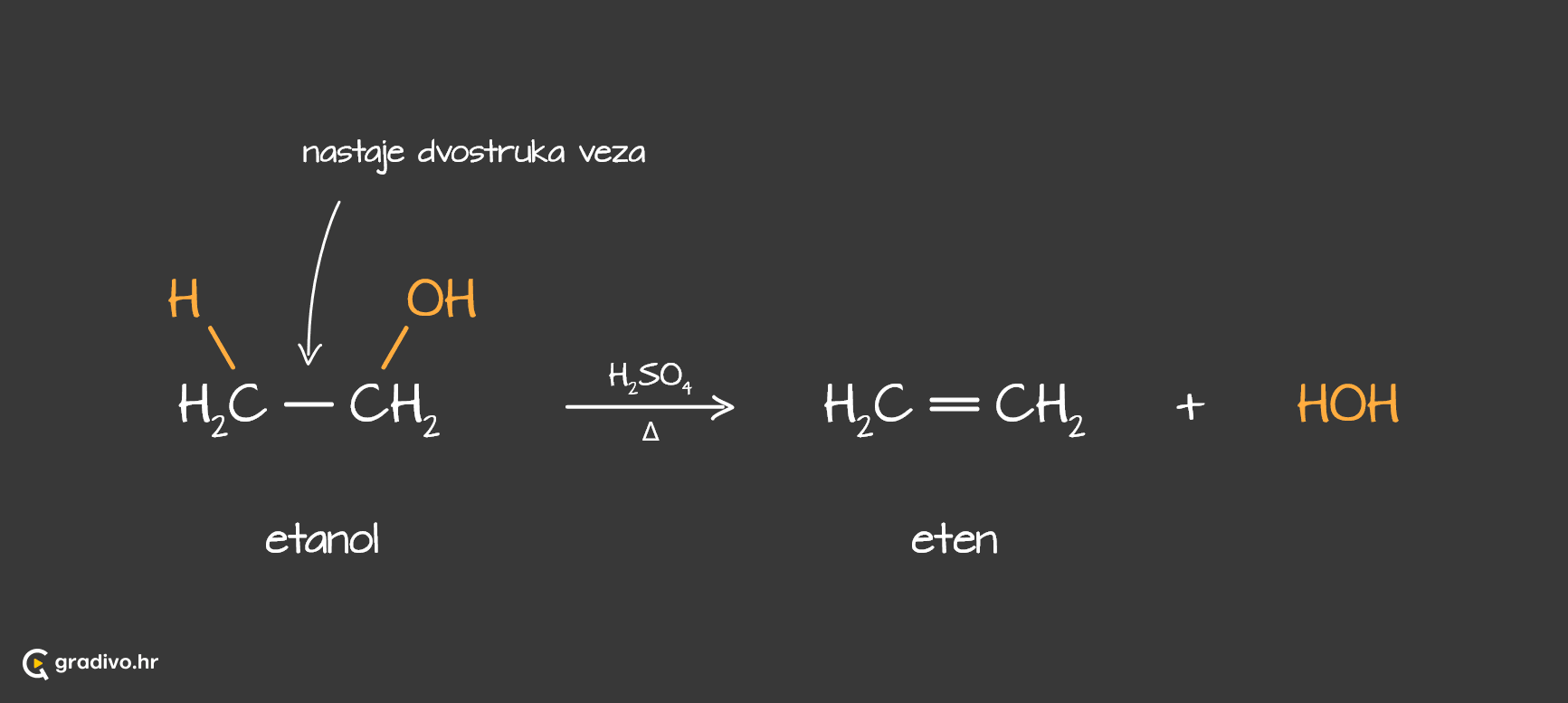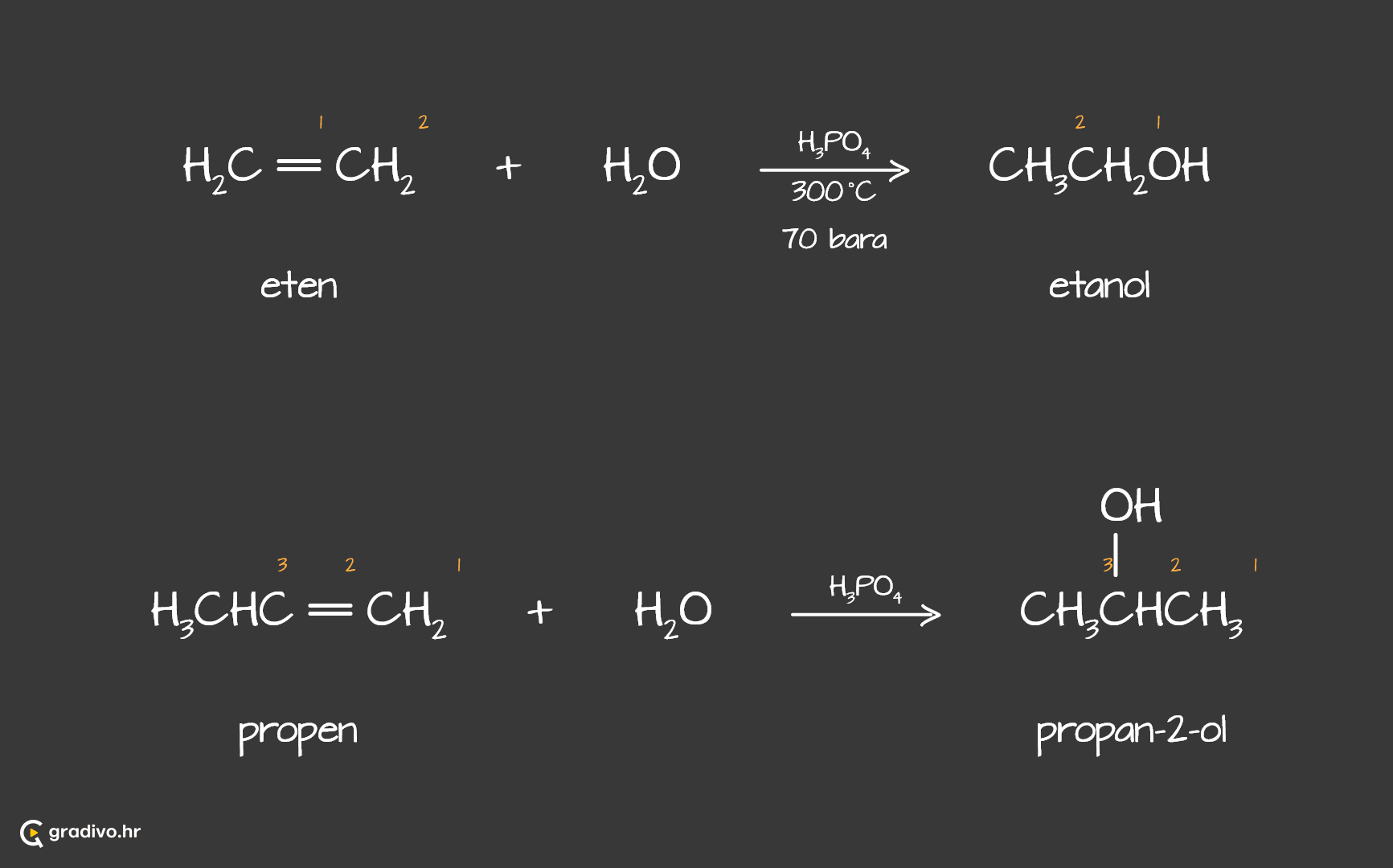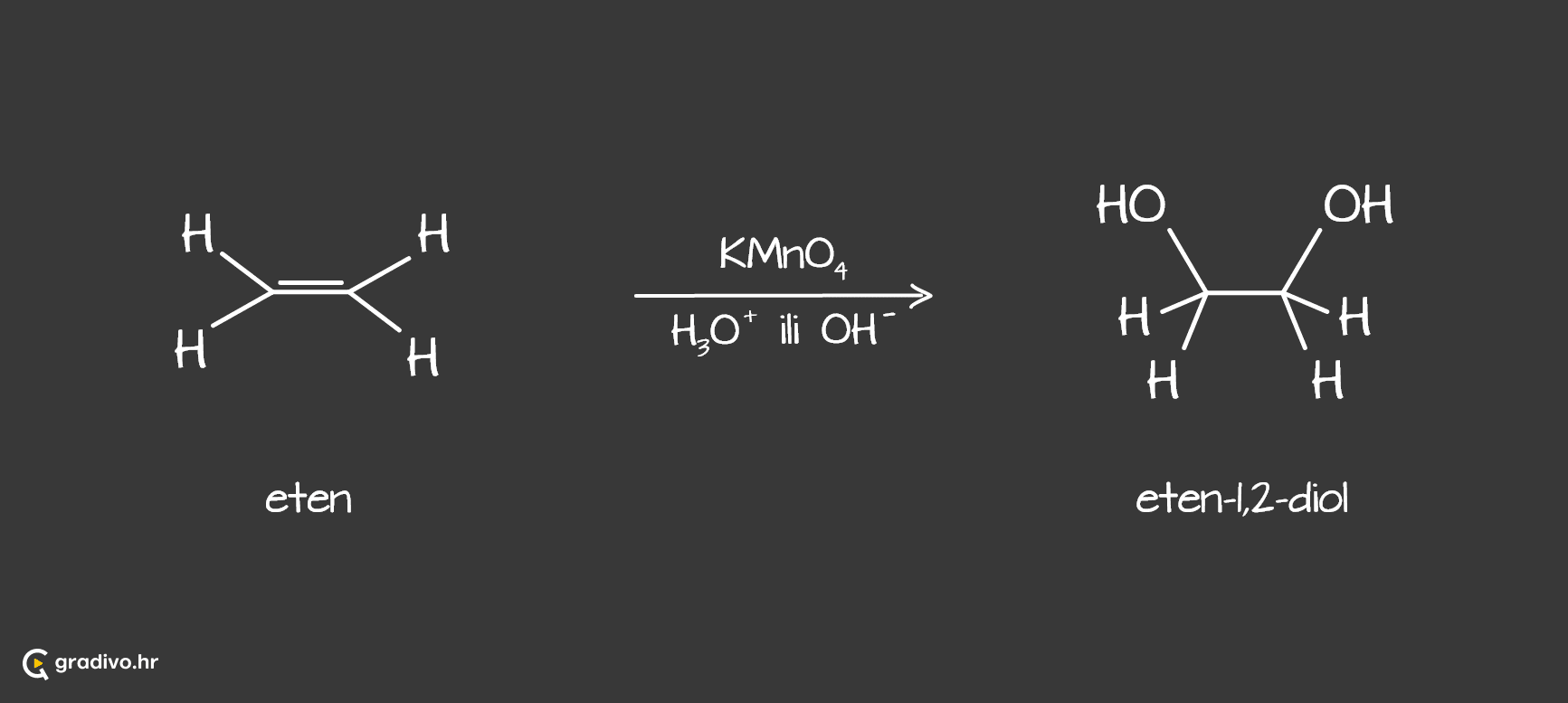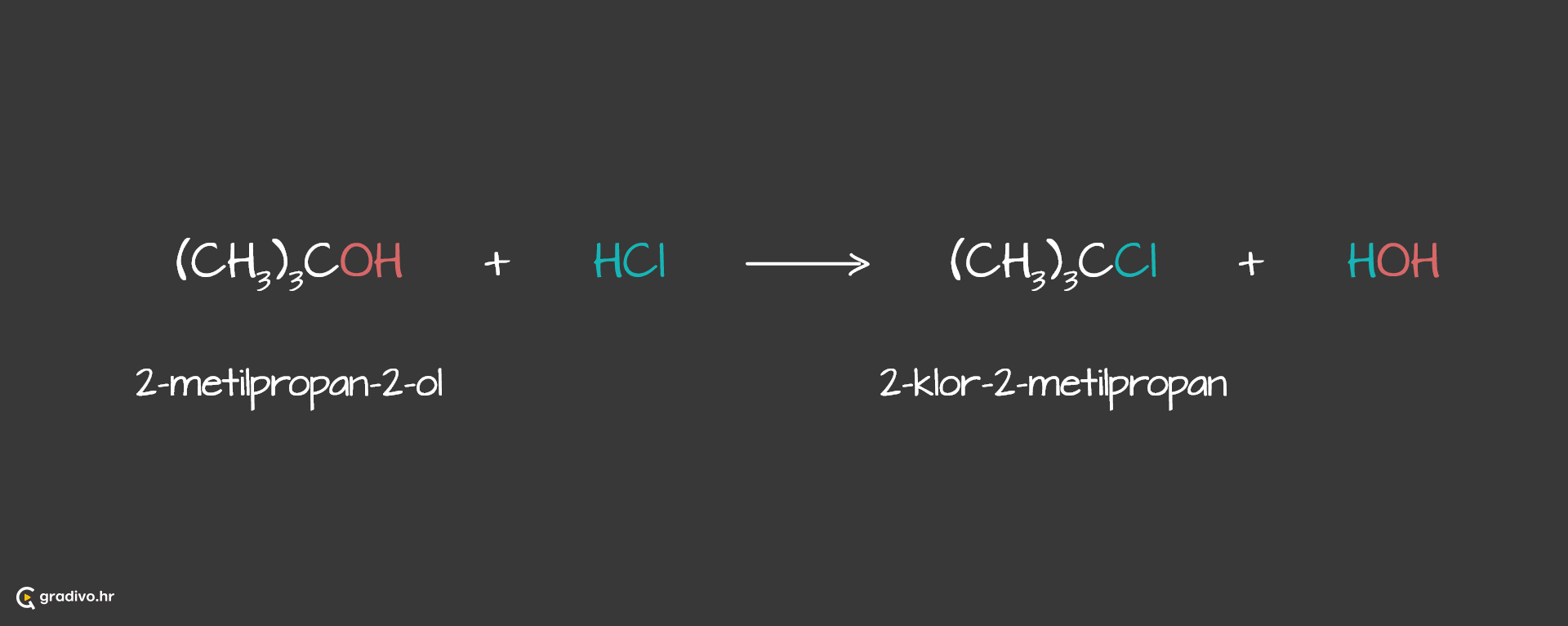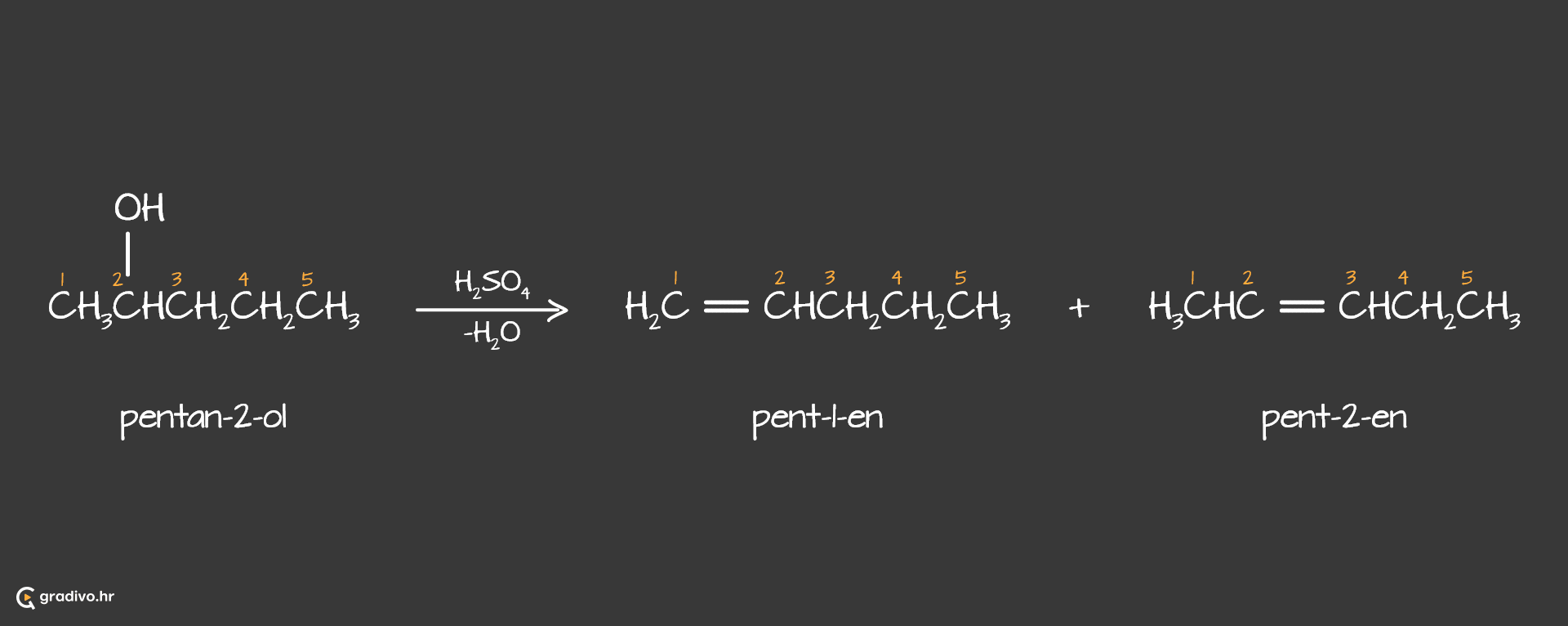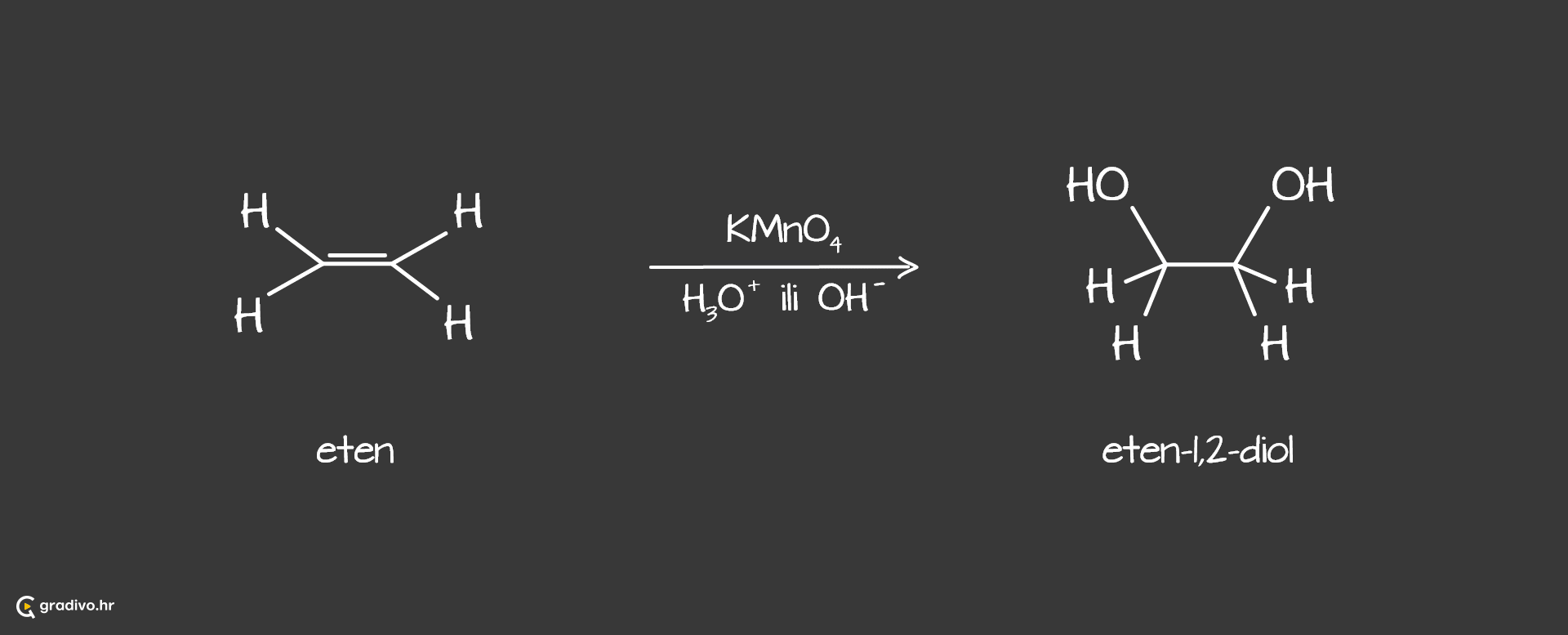Alkoholi i fenoli
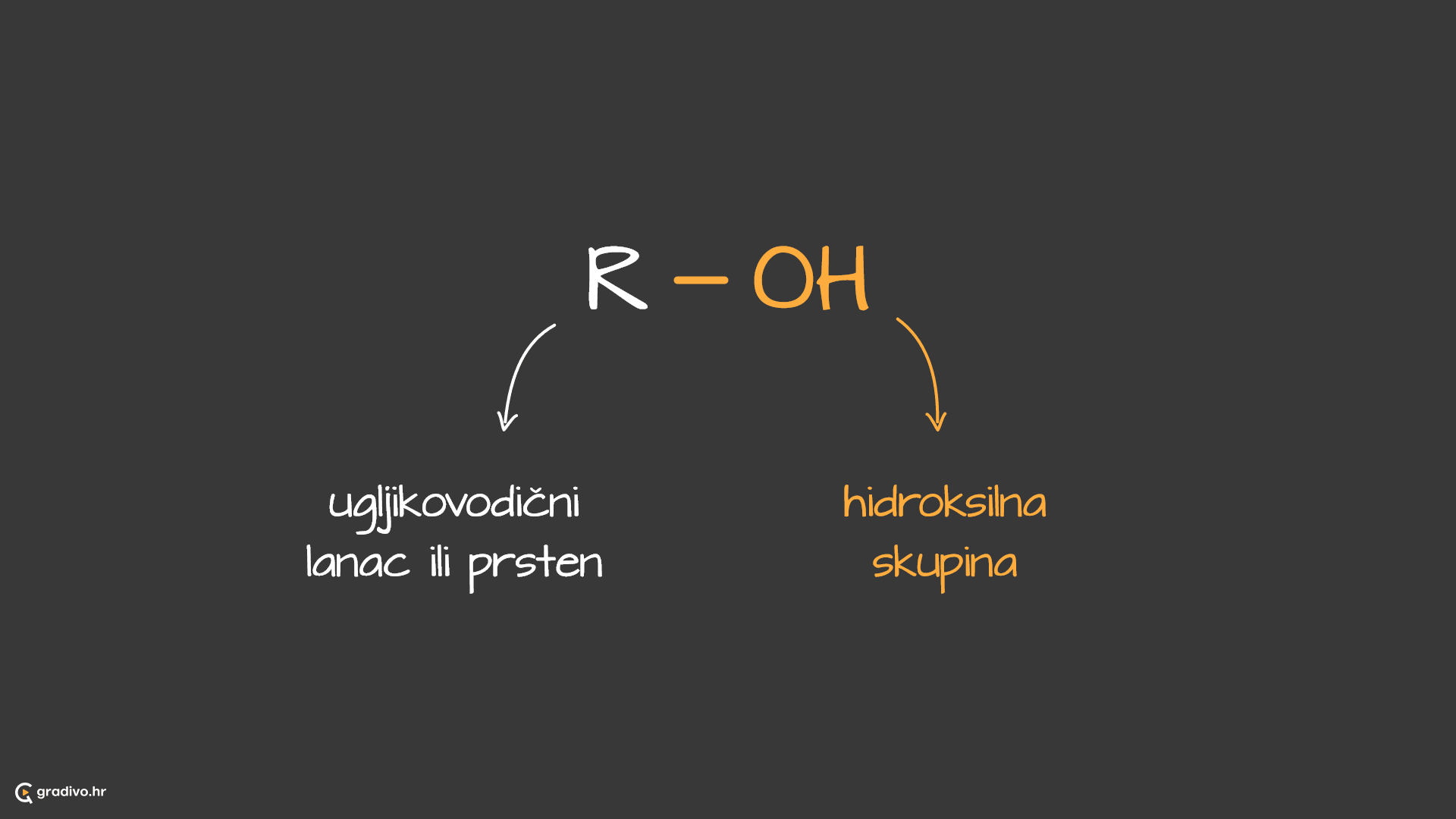
Svi alkoholi sadržavaju jednu ili više hidroksilnih skupina (-OH) vezanih za ugljikovodični lanac ili prsten. Ukoliko je -OH skupina vezana na benzenski prsten, takav alkohol se naziva fenol.

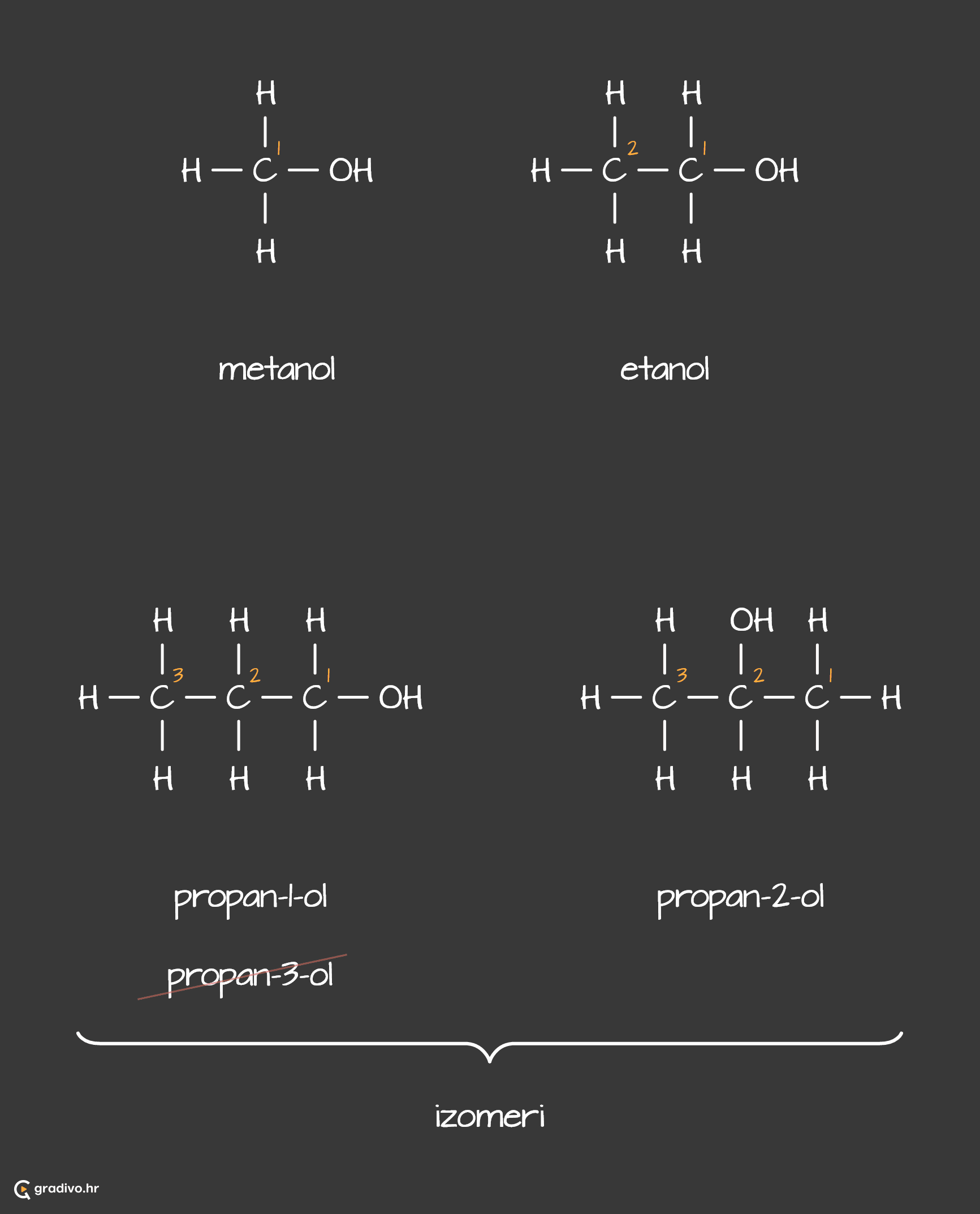
Imena alkohola tvore se od imena osnovnog ugljikovodika i nastavka -ol.
Smjer brojanja najduljeg lanca počinje ugljikovim atomom na kojeg je vezana hidroksilna skupina.

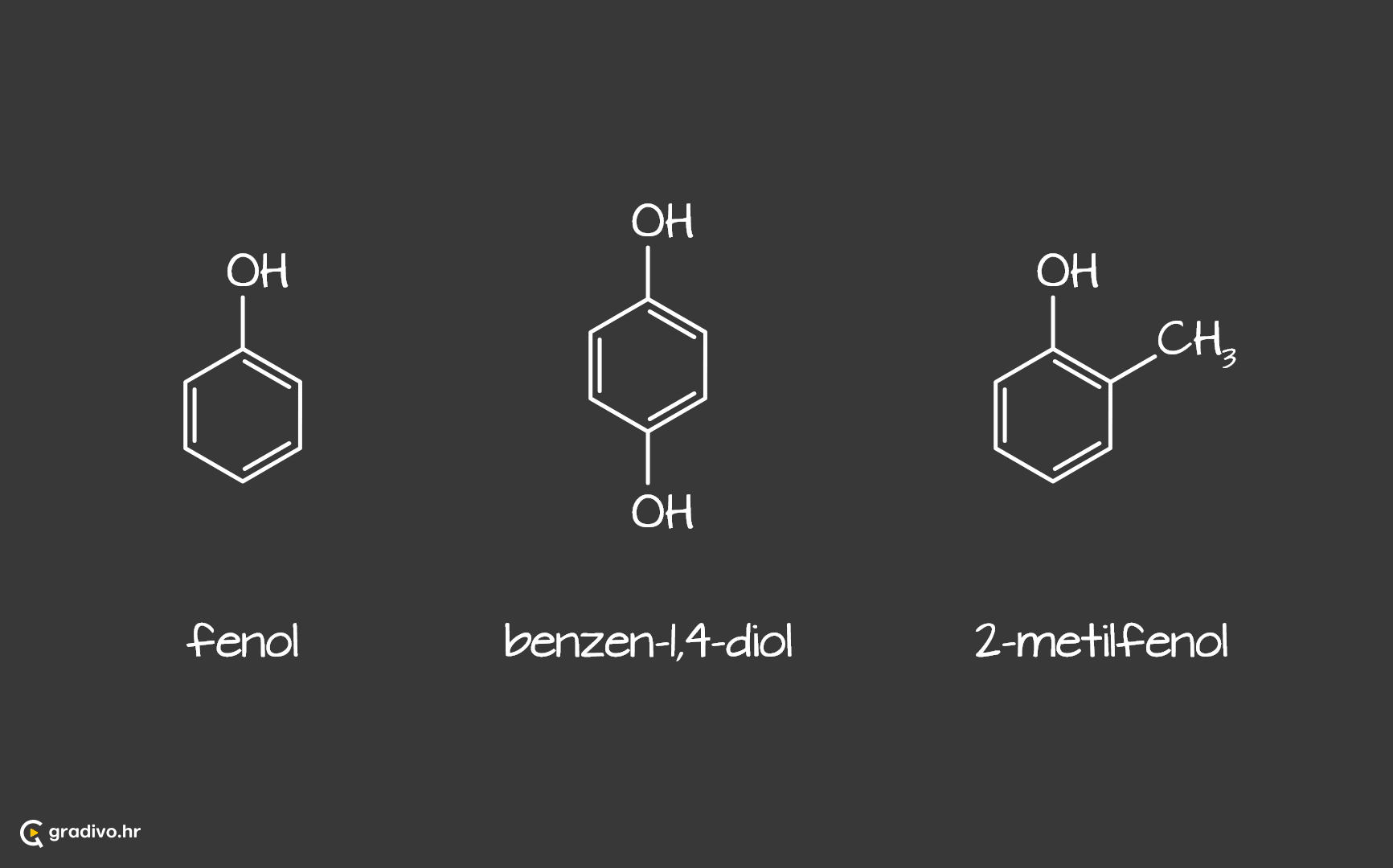
Ako se u strukturi aromatskog ugljikovodika benzena jedan atom vodika zamijeni hidroksilnom skupinom, dobijemo aromatski alkohol trivijalnog imena fenol po kojem se cijela skupina srodnih spojeva naziva fenolima.

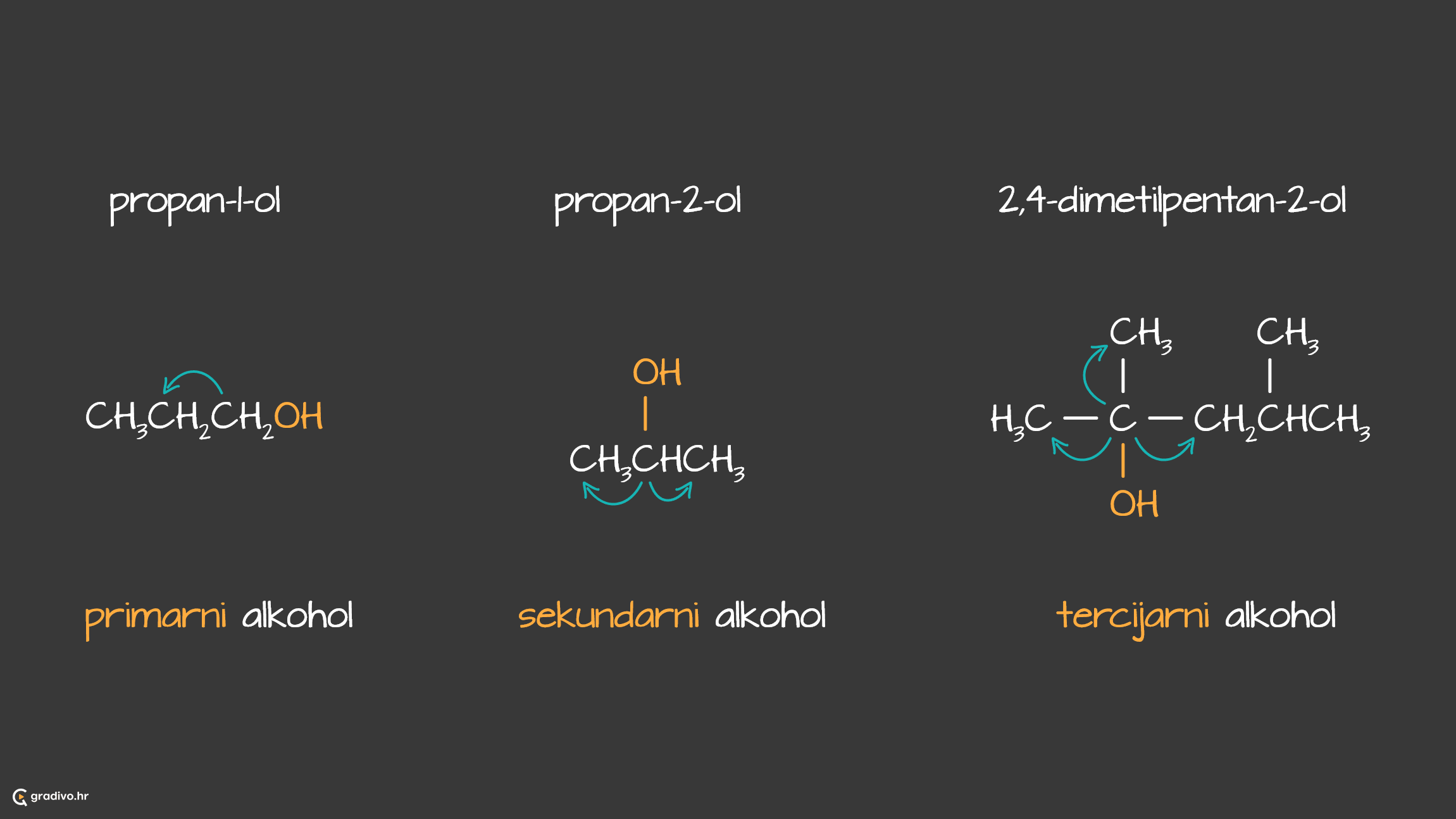
Alkohole dijelimo s obzirom na položaj -OH skupine i s obzirom na broj -OH skupina.
Ukoliko se -OH skupina nalazi na C atomu koji tvori vezu samo s još jednim C atomom, takav alkohol se naziva primarnim. Ukoliko se -OH skupina nalazi na C atomu koji tvori veze s dva C atoma, takav alkohol se naziva sekundarni. Ukoliko se -OH skupina nalazi na C atomu koji tvori veze s tri C atoma, takav alkohol se naziva tercijarni.

Ukoliko alkohol ima jednu -OH skupinu, on se naziva jednovalnetnim, ukoliko ih ima dvije, naziva se dvovalentni, a ukoliko ih ima tri, naziva se trovalentni.


Međumolekulske interakcije
Alkoholi su polarne molekule te kao takve jesu dipoli. Jedan dio molekule je hidrofilan (-OH skupina), dok je drugi dio hidrofoban. Takve molekule, koje imaju i hidrofilan i hidrofoban dio, nazivaju se amfipatske molekule.
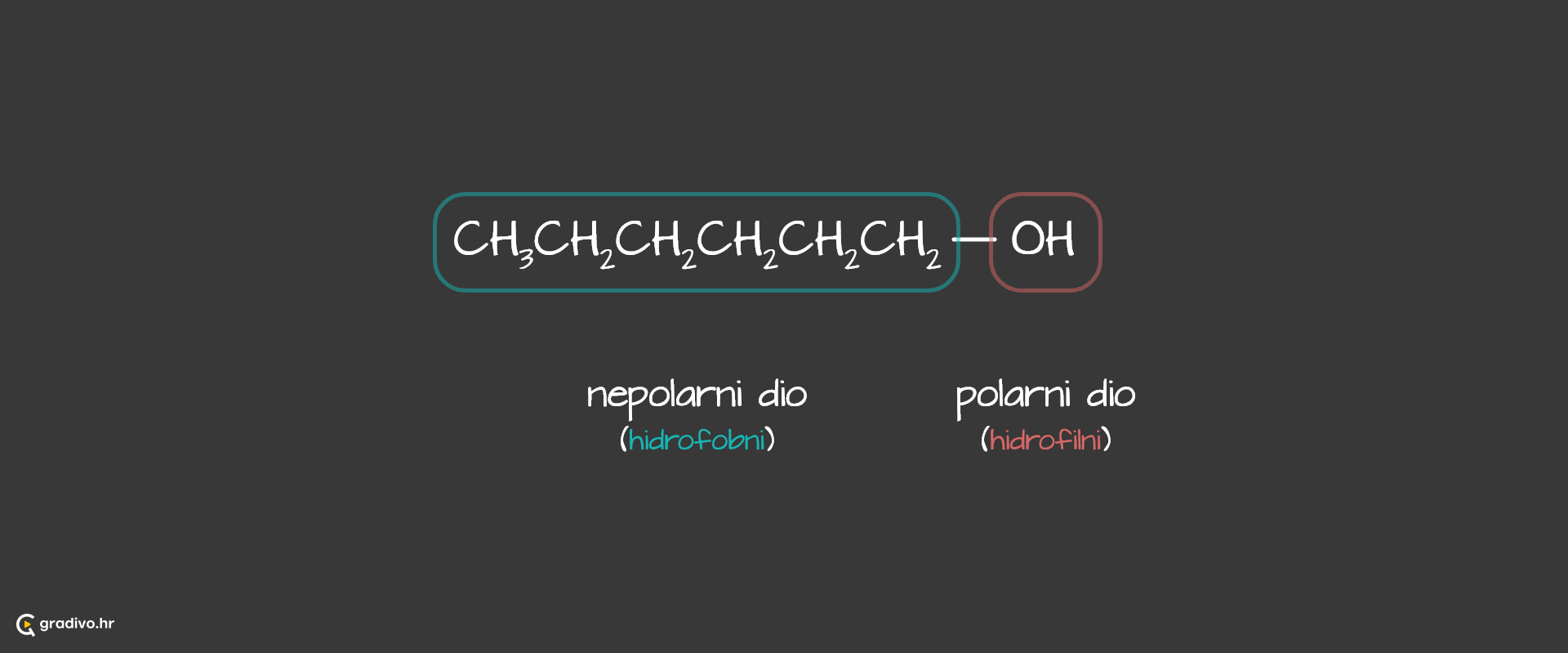

Ukoliko su molekule alkohola dipoli, između molekula alkohola jedne od interakcija jesu dipol-dipol interakcije.
Zbog polarnosti -OH skupine, molekule alkohola međusobno se povezuju vodikovim vezama (slika lijevo), kako međusobno, tako i s molekulama vode (slika desno).

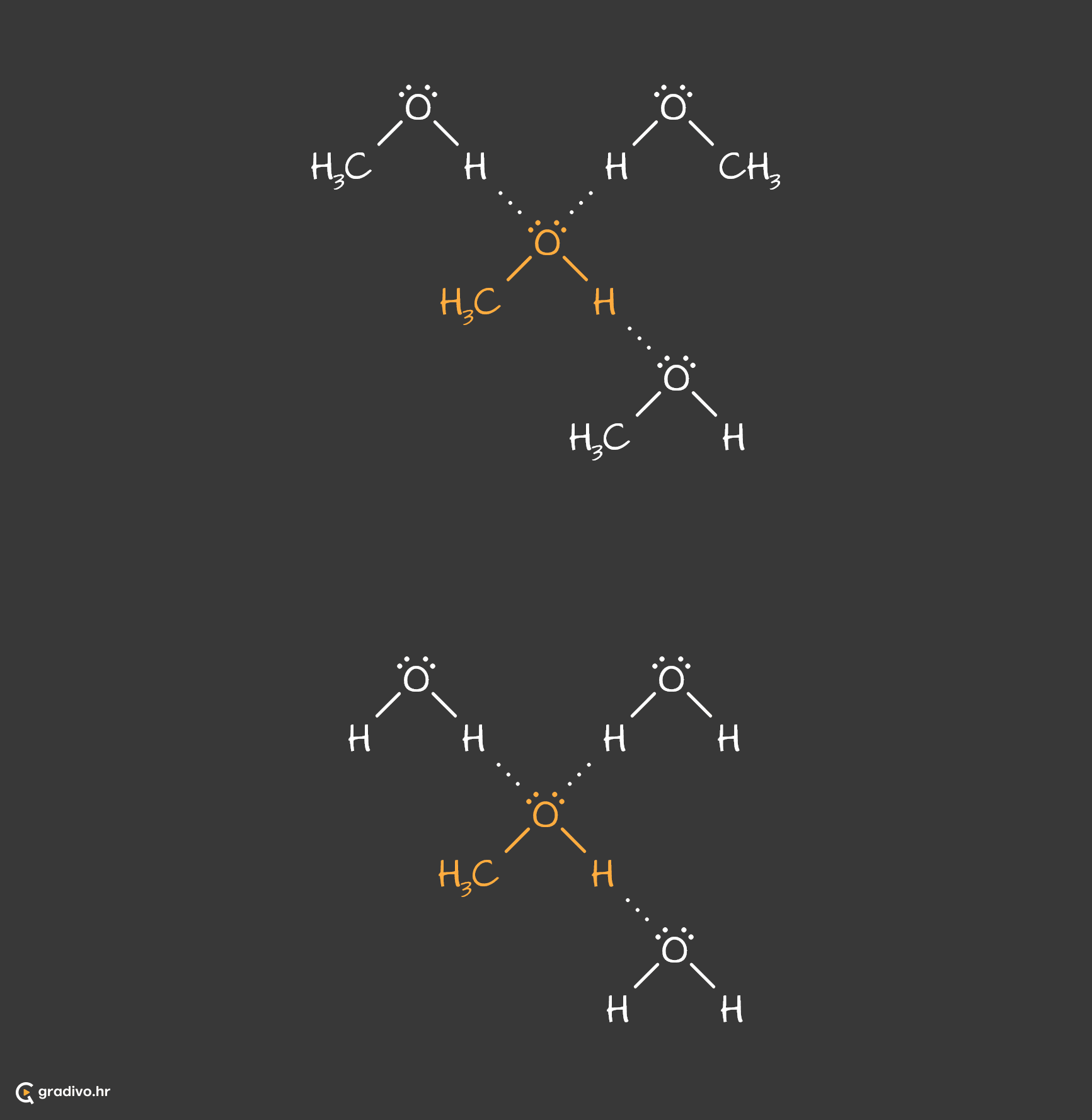
Fizikalna svojstva alkohola
Zbog vodikovih veza, vrelišta alkohola su znatno viša u odnosu na ugljikovodike slične molarne mase. Naime, vodikove su veze jače međumolekulske interakcije u odnosu na Londonove sile kojima su povezane molekule ugljikovodika.
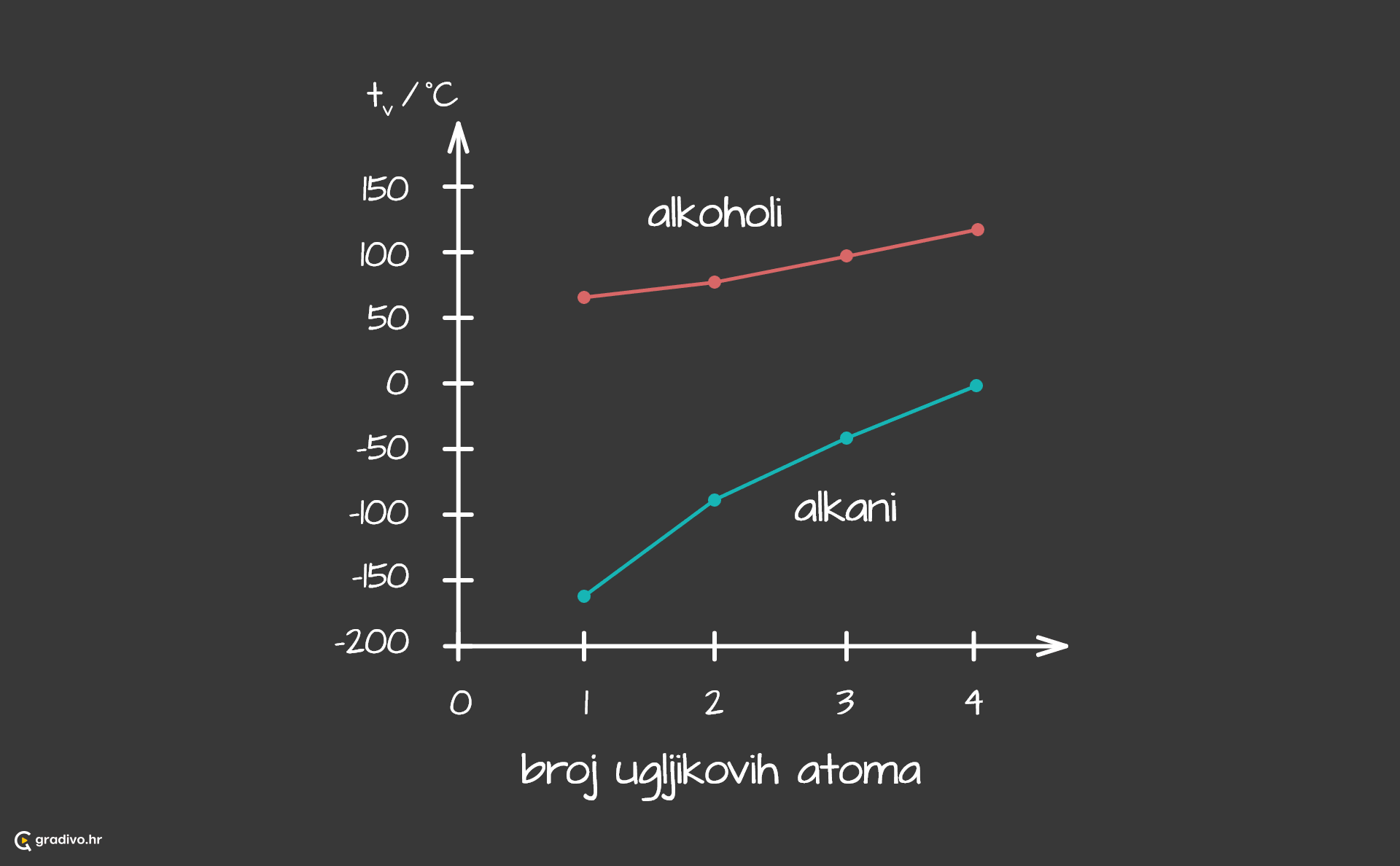

Kao što je vidljivo na grafičkom prikazu, vrelište alkohola je više, što je veća molarna masa alkohola. Razlog tomu jest to što je pri većoj molarnoj masi, sama molekula alkohola veća te svaka molekula ostvaruje više međumolekulskih interakcija koje stabiliziraju sam sustav i vrelište je tada više.

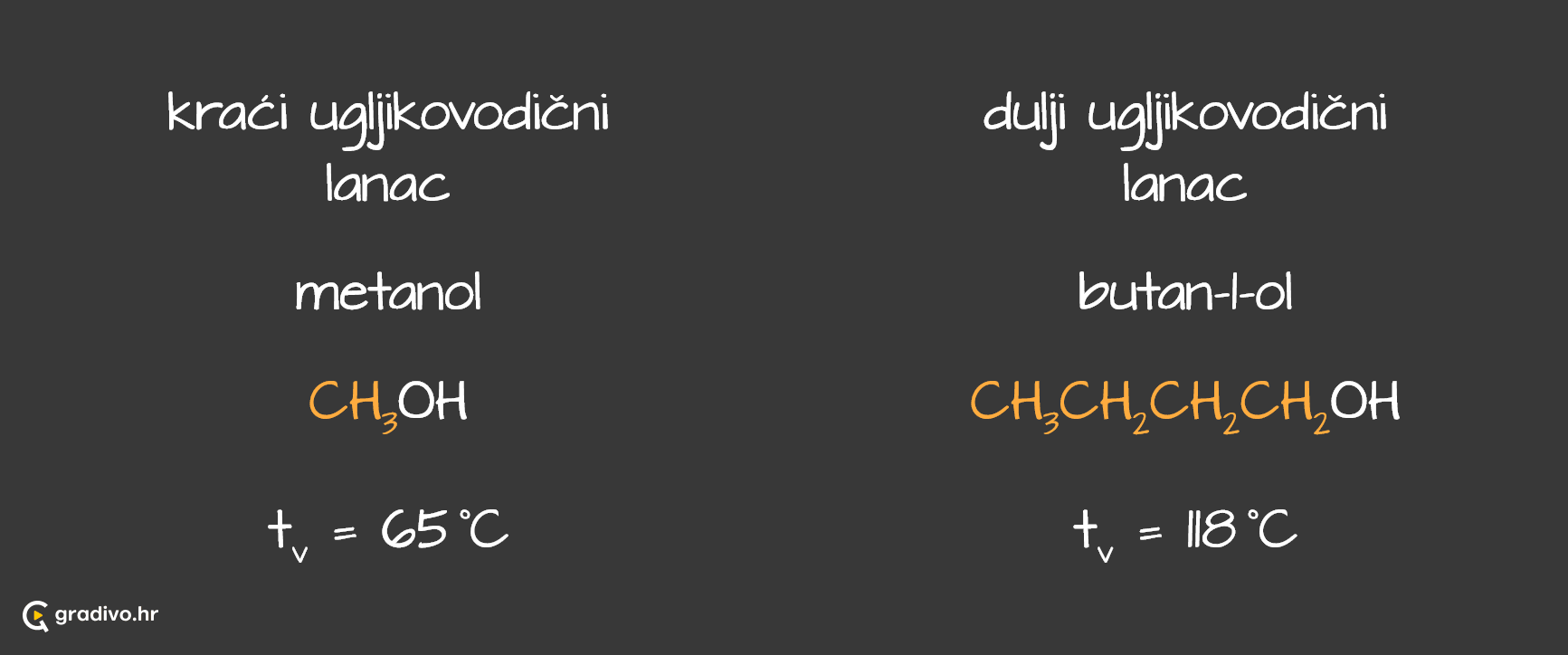
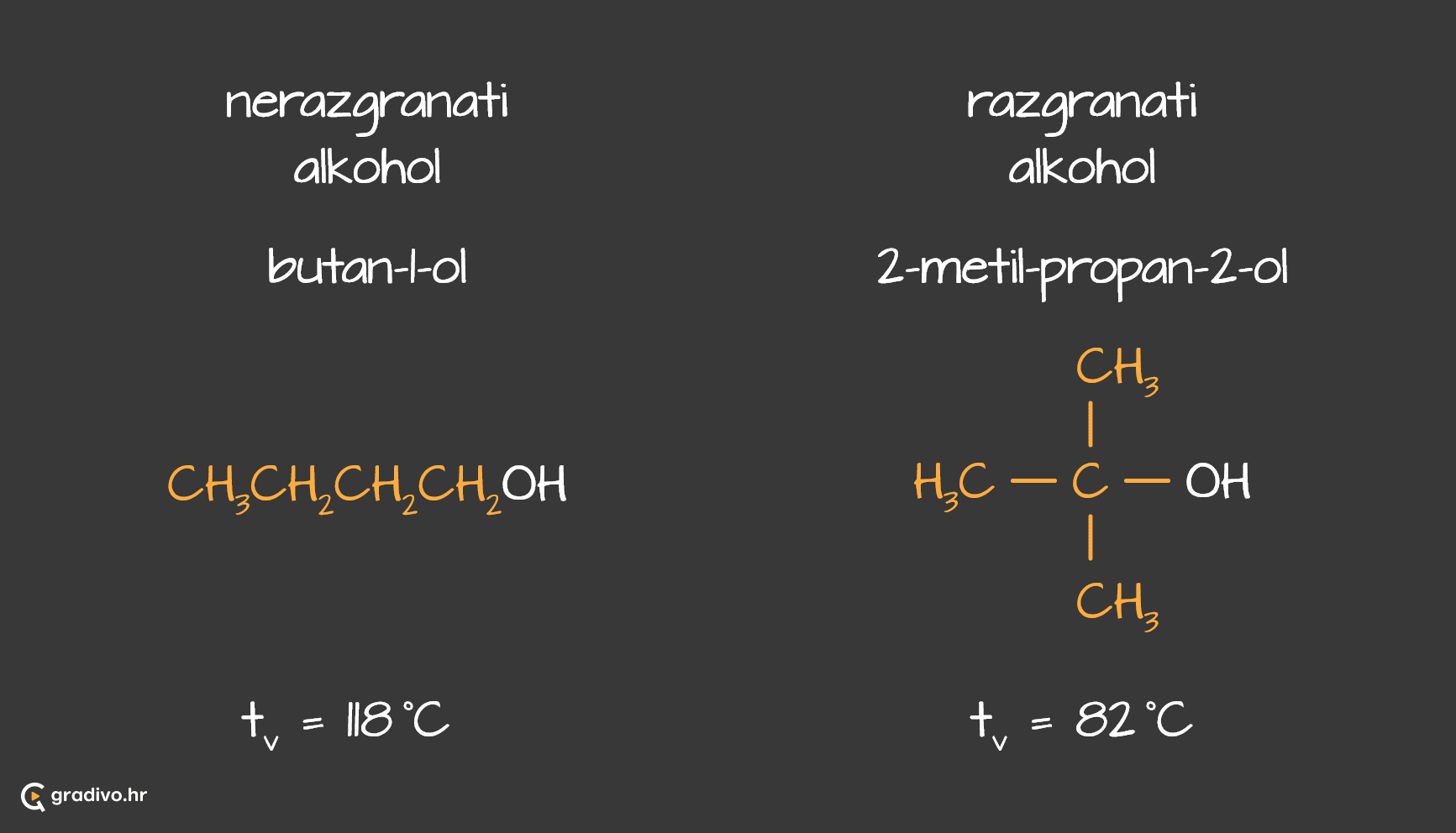
Vrelišta alkohola ovise i o razgrananosti nepolarnoga ugljikovodičnog dijela molekule. Što je lanac razgranatiji, vrelište je alkohola niže. Razlog tome jest to što je molekula manje razgranata, to je veći nepolarni dio. Ukoliko je nepolarni dio veći tj. dulji, to znači da molekula tvori više interakcija s drugim molekulama. Samim time će i ukupne interakcije biti jače i vrelište više.

Topljivost u vodi opada s brojem C atoma, a raste s brojm hidroksilnih skupina.
Topljivost alkohola u vodi temelji se na mogućnosti tvorbe vodikovih veza između molekula alkohola i molekula vode i o duljini i razgranatosti ugljikovodičnog ogranka - što je on dulji i manje razgranat, topljivost je manja.
Kemijska svojstva alkohola
Reakcija supstitucije - alkoholi u reakciji s halogenovodikom daju odgovarajuće halogenalkane i vodu.
Tercijarni alkoholi su najreaktivniji. Sekundarni, a pogotovo primarni alkoholi, vrlo sporo reagiraju s HCl, ali brže s HBr.
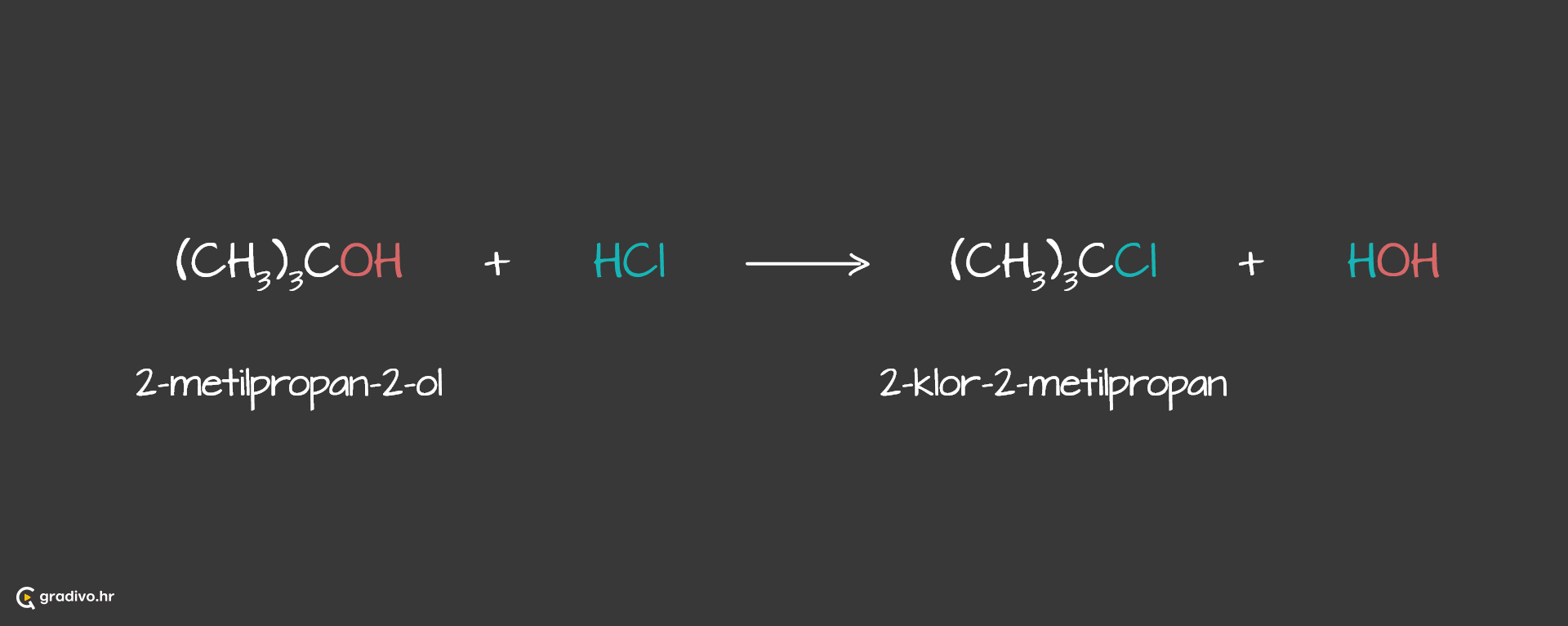
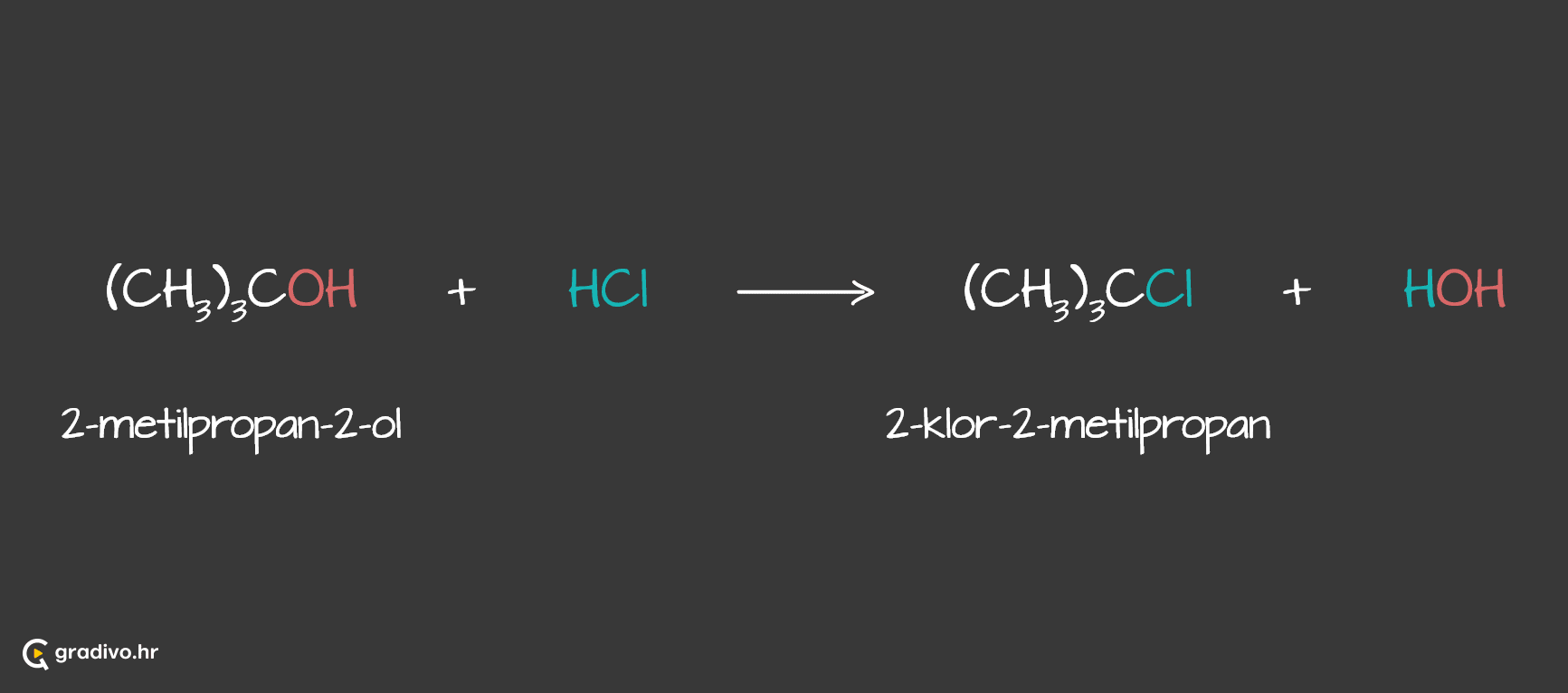


Eliminacija vode - dehidratiranje - u kiselim reakcijskim uvjetima iz alkohola nastaju odgovarajući alkeni i voda.

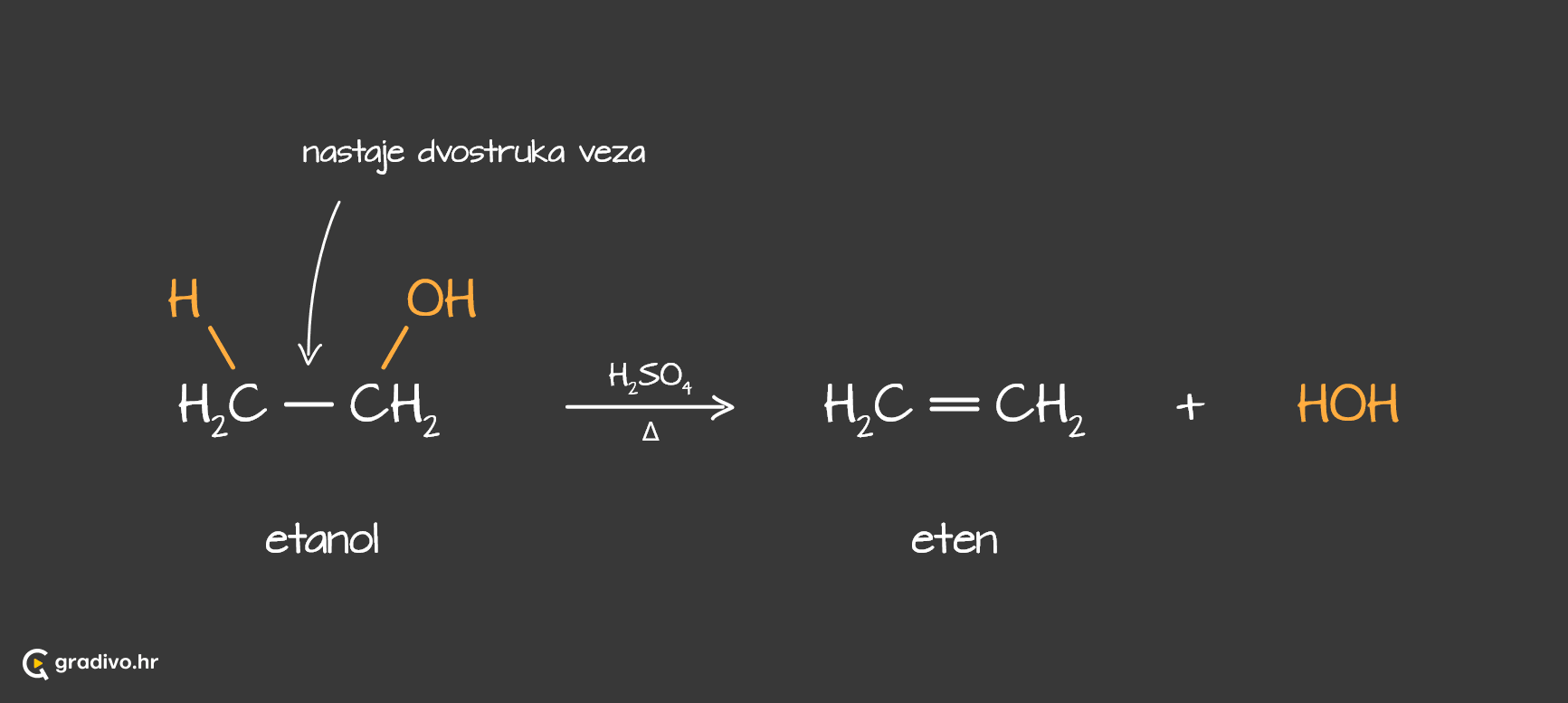
Reakcijom eliminacije vode iz pentan-2-ola nastaju dva produkta:
U pentan-2-olu C atom koji nosi hidroksilnu skupinu (α-ugljik) ima dva β-ugljika (C atomi koji su vezani na α-C atom) i stoga eliminacijom vodika s jednog ili drugog β-ugljika nastaju dva produkta.
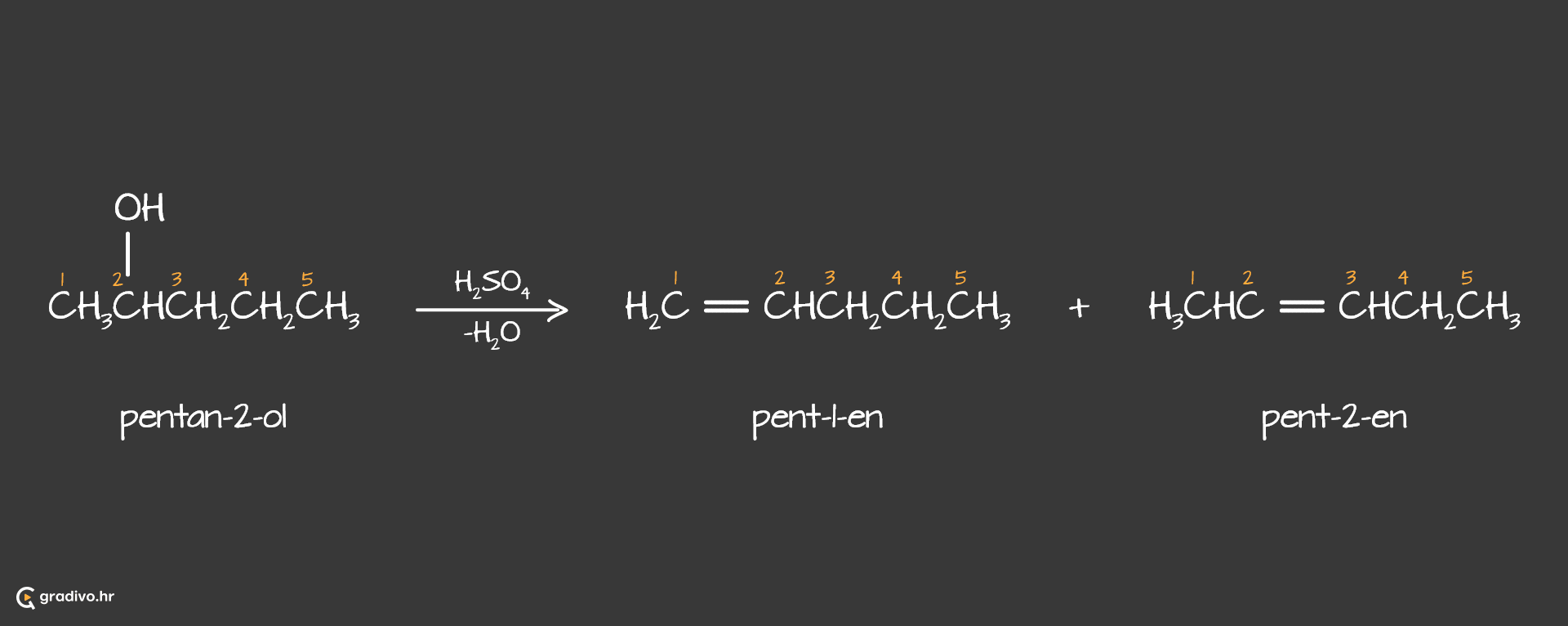

Zajcevljevo pravilo je empirijsko (eksperimentalno utvrđeno) pravilo za predviđanje glavnog proizvoda u reakciji eliminacije: alken koji nastaje u najvećoj količini je onaj u kome je dvostruka veza između ugljika odlazeće grupe i susjednog C atoma sa manjim brojem vodikovih atoma. Zbog toga je u eliminaciji vode iz pentan-2-ola glavni produkt pent-2-en.
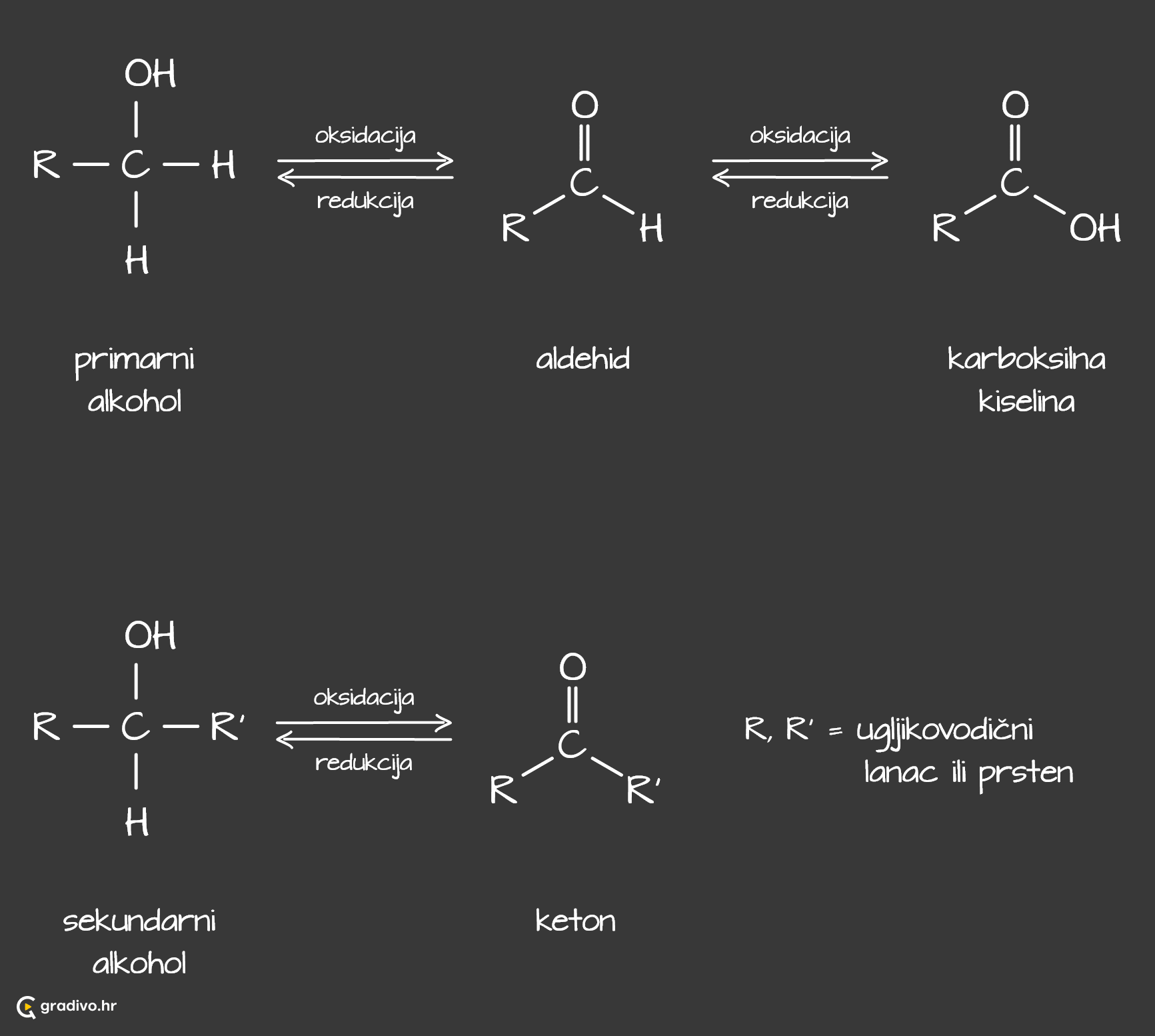
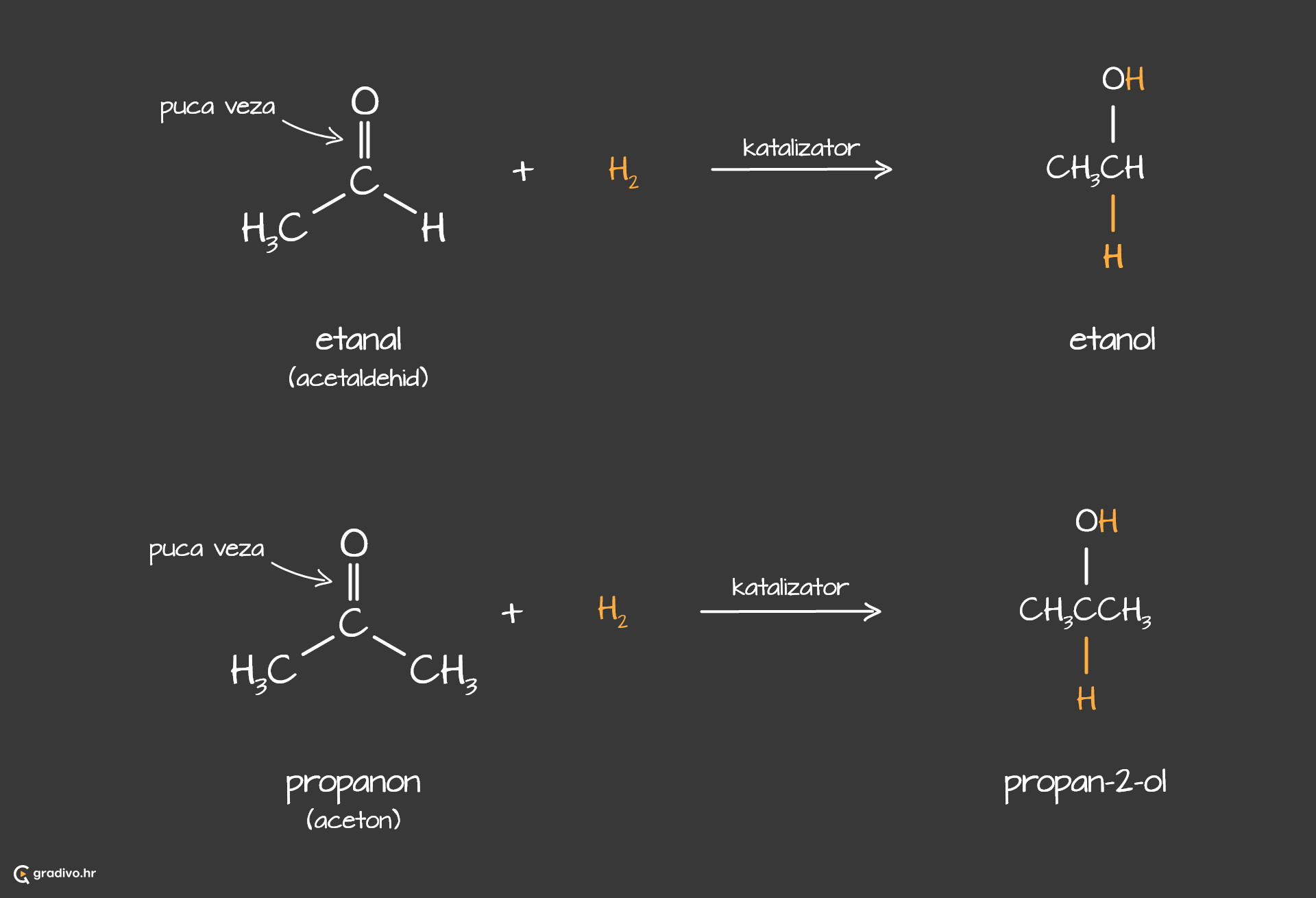
Oksidacija alkohola - primarne i sekundarne alkohole moguće je i oksidirati, pri čemu je primarne alkohole moguće oksidirati do aldehida i karboksilnih kiselina, a sekundarne alkohole do ketona.

Gorenje alkohola također je reakcija oksidacije, pri čemu, uz dovoljan pristup kisika, nastaju voda i ugljikov(IV) oksid. Različite boje plamena tijekom gorenja metanola i etanola jednostavan su način njihova kvalitativnog dokazivanja.
Zbog polarnosti veze O–H alkoholi s bazama reagiraju kao slabe kiseline. Primjerice, reakcijom etanola s elementarnim natrijem heterolitički se cijepa veza O–H, pri čemu nastaju plinoviti vodik i natrijeva sol konjugirane baze etanola – natrijev etoksid (CH3CH2ONa). Budući da su alkoholi vrlo slabe kiseline, njihove su konjugirane baze, alkoksidi, jake baze koje se često uporabljuju u organskim sintezama.


Alkoholi se mogu pripraviti na tri načina: hidratacijom alkena, oksidacijom alkena te redukcijom aldehida i ketona.
Hidratiranje alkena - adicija vode na molekule alkena u kiselim reakcijskim uvjetima.

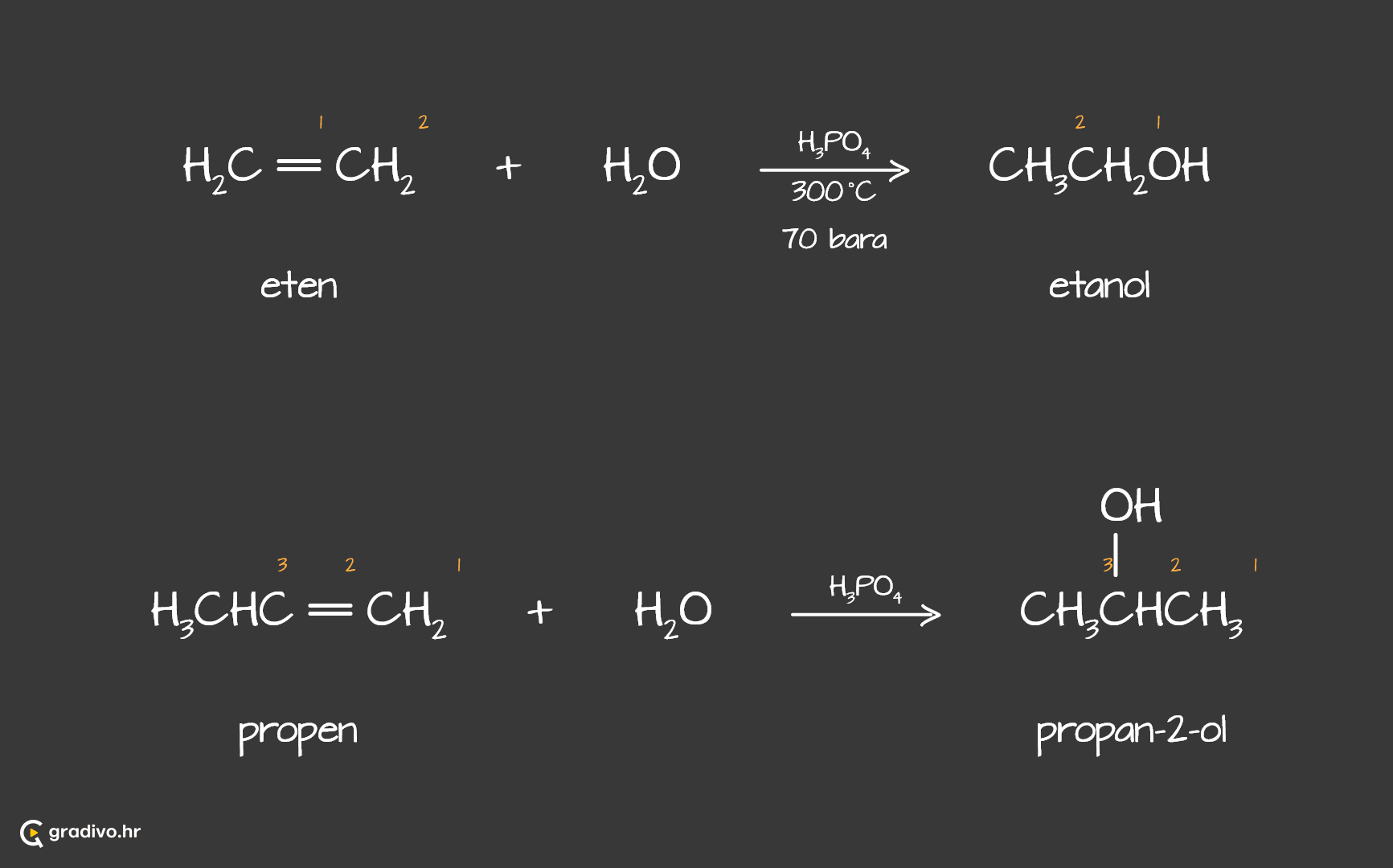
Oksidacijom alkena vodenom otopinom kalijeva permanganata nastaju alkoholi dioli.
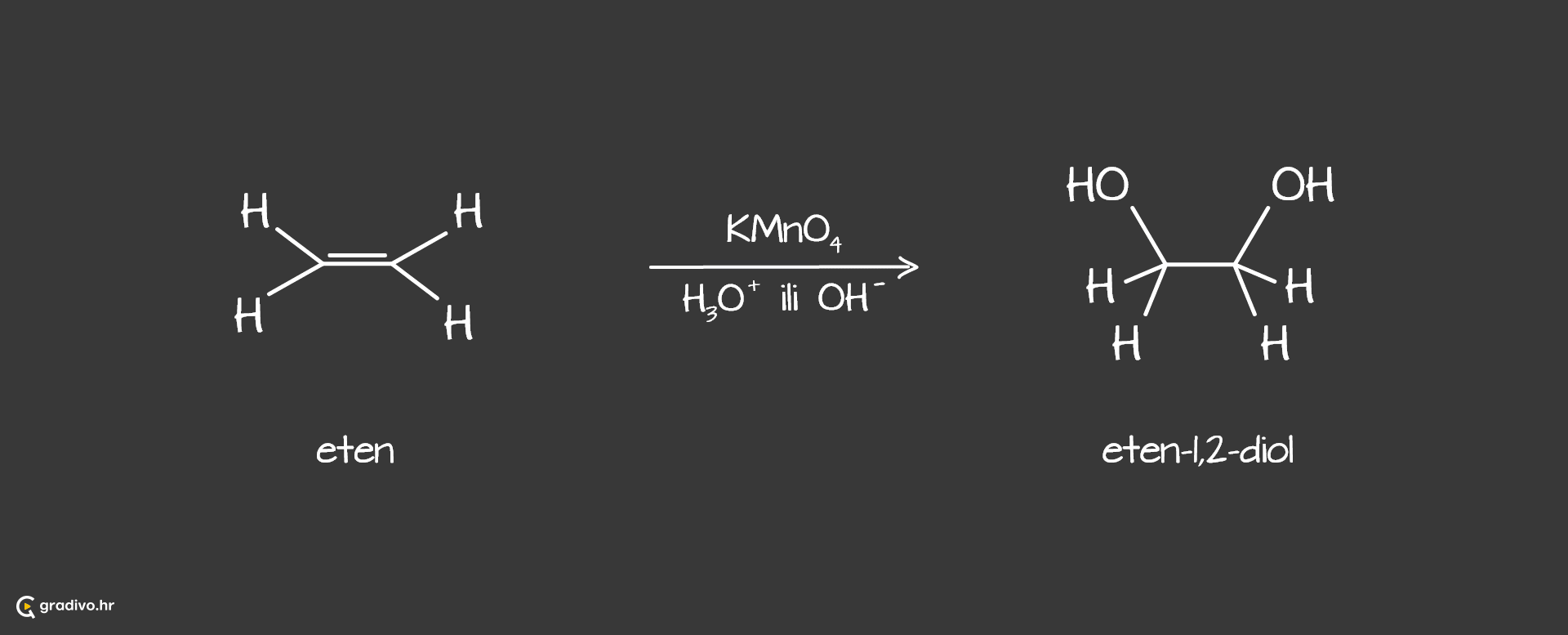
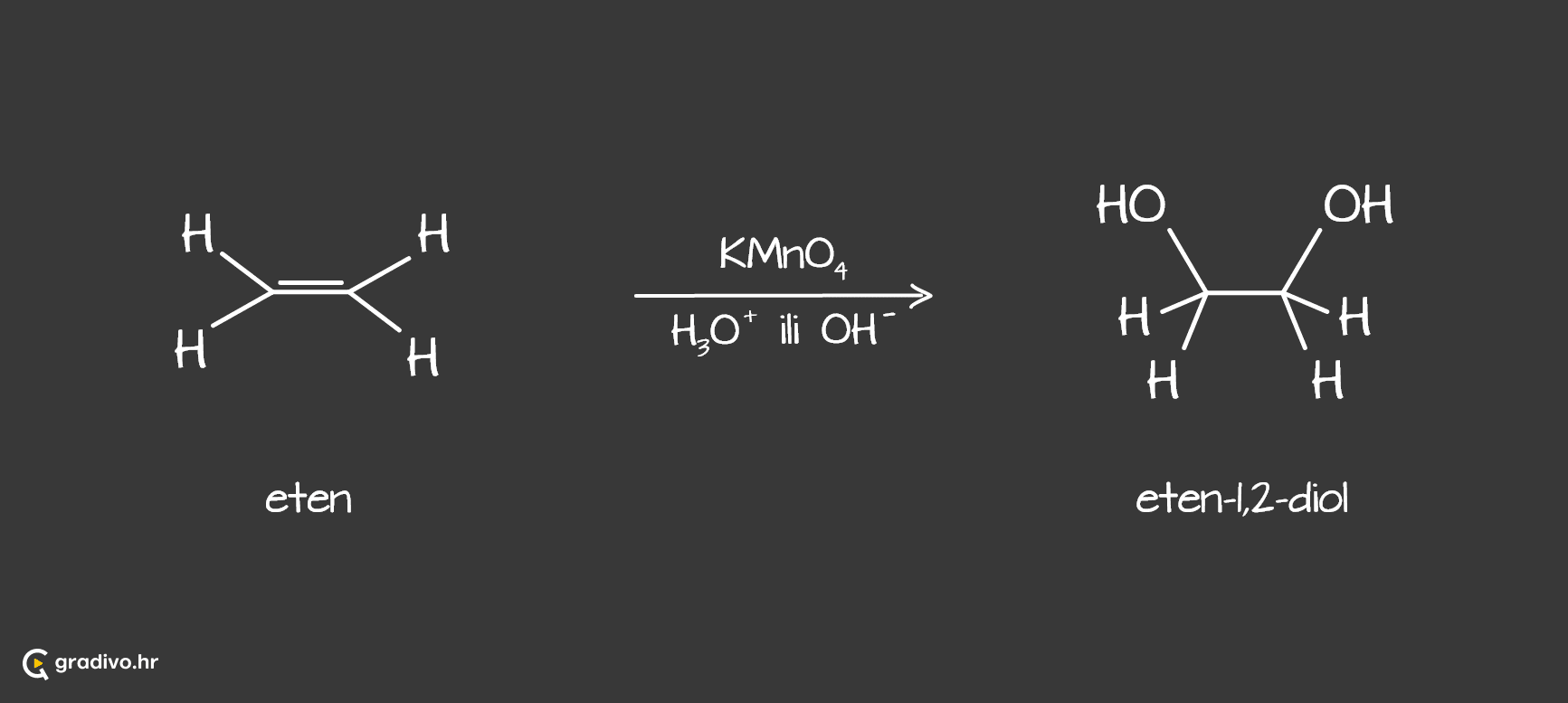
Redukcija aldehida nastaju primarni alkoholi, a redukcijom ketona nastaju sekundarni alkoholi. Aldehidi i ketoni reduciraju se vodikom pa se ta reakcija naziva hidrogeniranje.

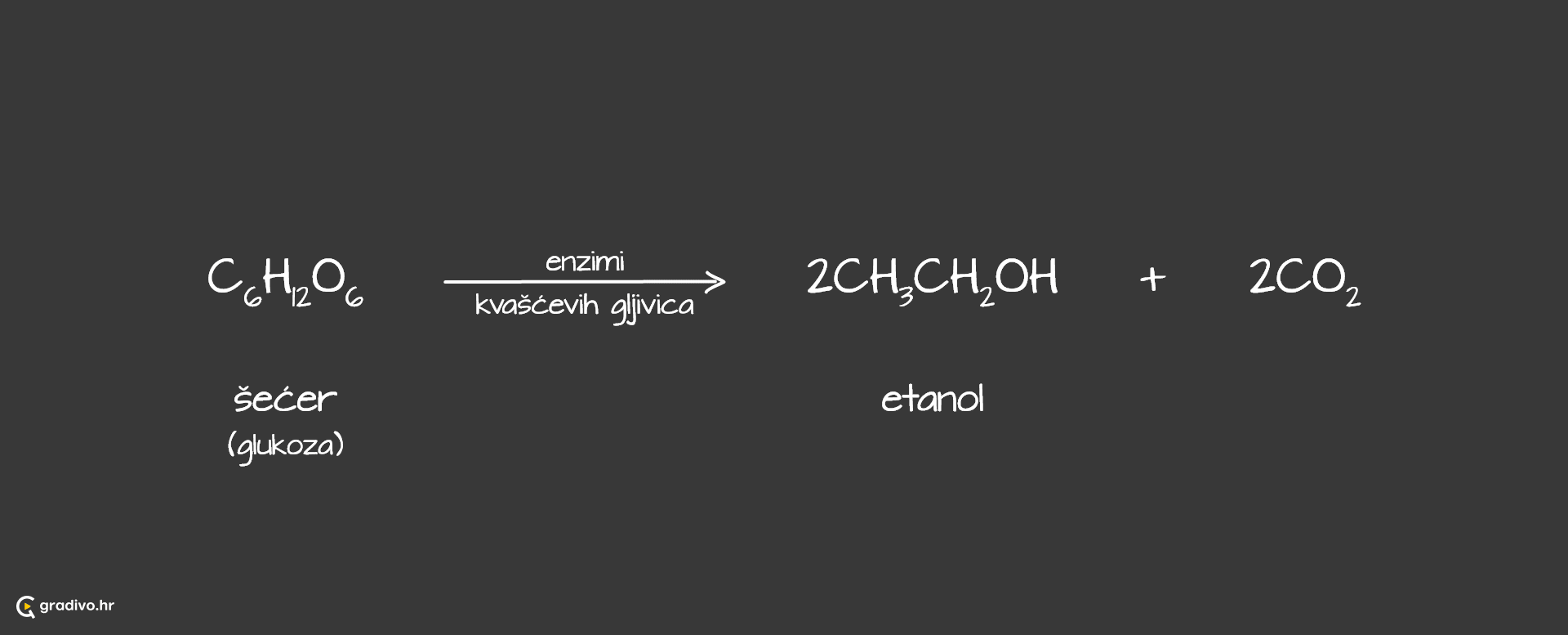
Etanol, najvažniji od svih alkohola, od davnina se dobiva postupkom alkoholnog vrenja (fermentacije). Vrenje se odigrava u stanicama kvasca bez prisutnosti kisika djelovanjem skupine enzima koji se zajedničkim imenom zovu zimaze.
Alkoholnim se vrenjem šećer iz voća ili nekoga drugog prirodnog izvora, u prisutnosti enzima iz kvaščevih gljivica, pretvara u etanol i ugljikov(IV) oksid.

Eteri
Postoje organski spojevi – derivati vode, kojoj su oba vodikova atoma zamijenjena ugljikovodičnim lancem ili prstenom, a nazivaju se eteri. Većinu etera čine kemijski relativno nereaktivni spojevi, pa se zato uporabljuju kao polarna organska otapala, po polarnosti odmah iza vode i alkohola.


Ukoliko se s obje strane kisikova atoma nalaze iste ugljikovodične skupine, takvi eteri nazivaju se simetrični, a oni, čije su skupine različite, nazivaju se asimetrični.


Eteri su izrazito zapaljive tekućine.
Vrelišta etera su ista ili malo viša od vrelišta alkana sličnih molekulskih masa te znatno niža od vrelišta alkohola sličnih molekulskih masa.
Molekule etera s molekulama vode tvore vodikove veze.
Na topljivost etera u vodi utječe veličina te razgranatost ugljikovodičnih ogranaka.
Gustoća etera (0,71 g cm–3) manja je od gustoće vode i eter pliva na vodi.
Danas se kao anestetici tijekom kirurških zahvata rabe i eteri – pentran i entran.