sniženje tlaka pare otapala ,sniženje ledišta ,povišenje vrelišta ,osmotski tlak .
Sniženje tlaka para otapala
Tekućine isparavanjem prelaze u plinovitu fazu. Tekućina koja se nalazi u otvorenoj posudi isparava postupno, čak i pri temperaturama nižim od temperature vrenja, sve dok sva tekuća faza ne prijeđe u plinovitu fazu. U zatvorenoj posudi tekućina također isparava, no ne prelazi sva tekuća faza u plinovitu. Isparavanjem parcijalni tlak plinovite faze iznad tekućine raste dok se ne ustali. Isparavanje je proces prelaska iz tekućega u plinovito agregacijsko stanje, a do isparavanja dolazi na površini tekućine. Vrenje je isparavanje pri temperaturi vrenja.
Sniženje tlaka para možemo objasniti na primjeru metanolne otopine natrijeva klorida.
Plinoviti se metanol nalazi u ravnoteži s tekućim metanolom pri tlaku p, koji nazivamo tlak pare metanola. Ravnotežni tlak pare iznad čistog metanola označit ćemo zvjezdicom
U otopini natrijeva klorida u metanolu dolazi do isparavanja tekućeg metanola i istodobne kondenzacije plinovitog metanola. U ravnoteži s otopinom nalazi se para metanola. Dodatkom natrijeva klorida

Tlak para otapala (
Množinski udio otapala u nekoj otopini uvijek je manji od 1 (
Tlak pare iznad otopine manji je od tlaka pare iznad čistog otapala, tj.
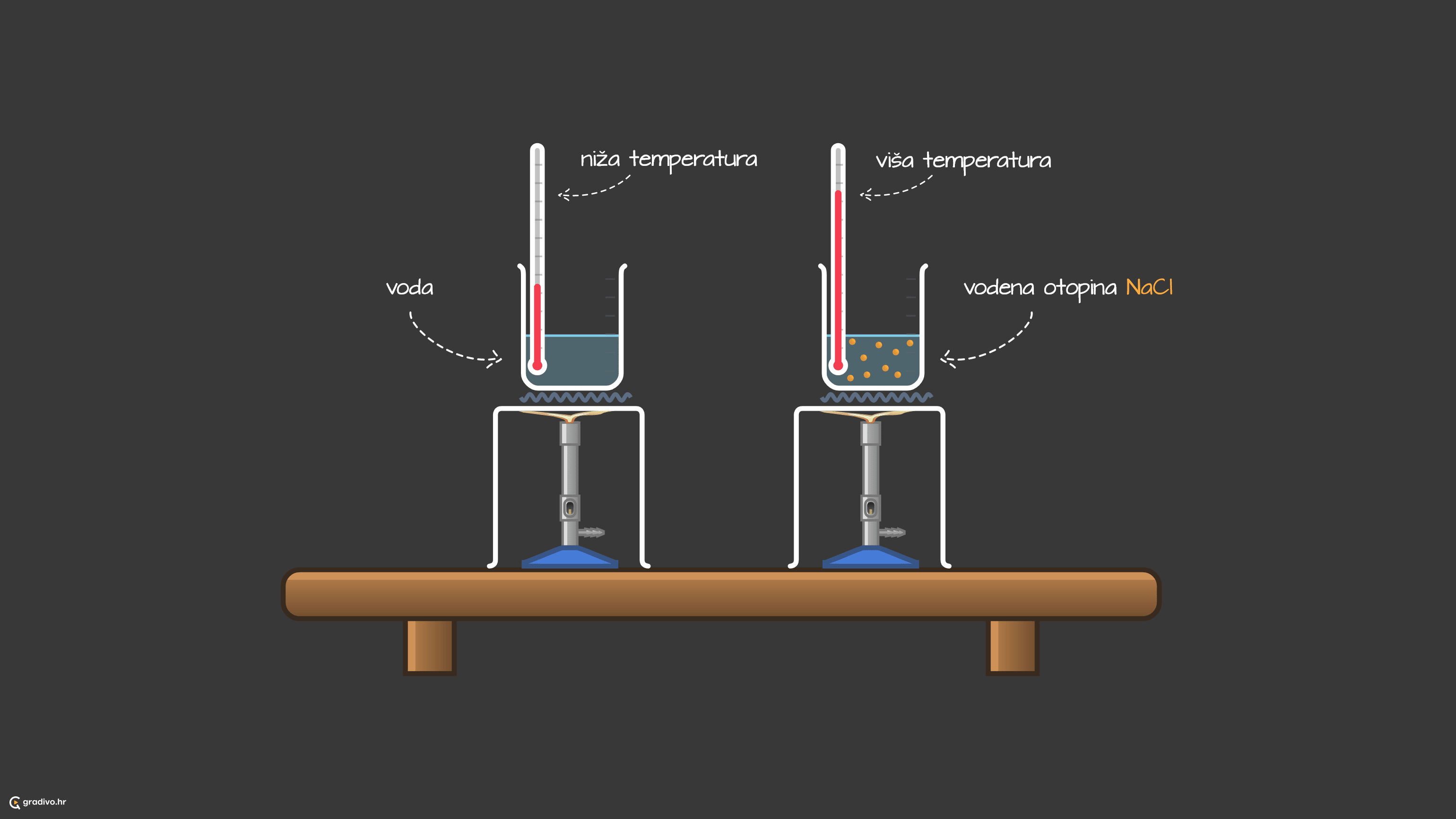
Povišenje vrelišta
Otapanjem tvari u tekućinama
Vrelište otopine nehlapljive tvari uvijek je više od vrelišta otapala. Za koliko stupnjeva će se promjeniti vrelište otopine u odnosu na čisto otapalo proučava
gdje je
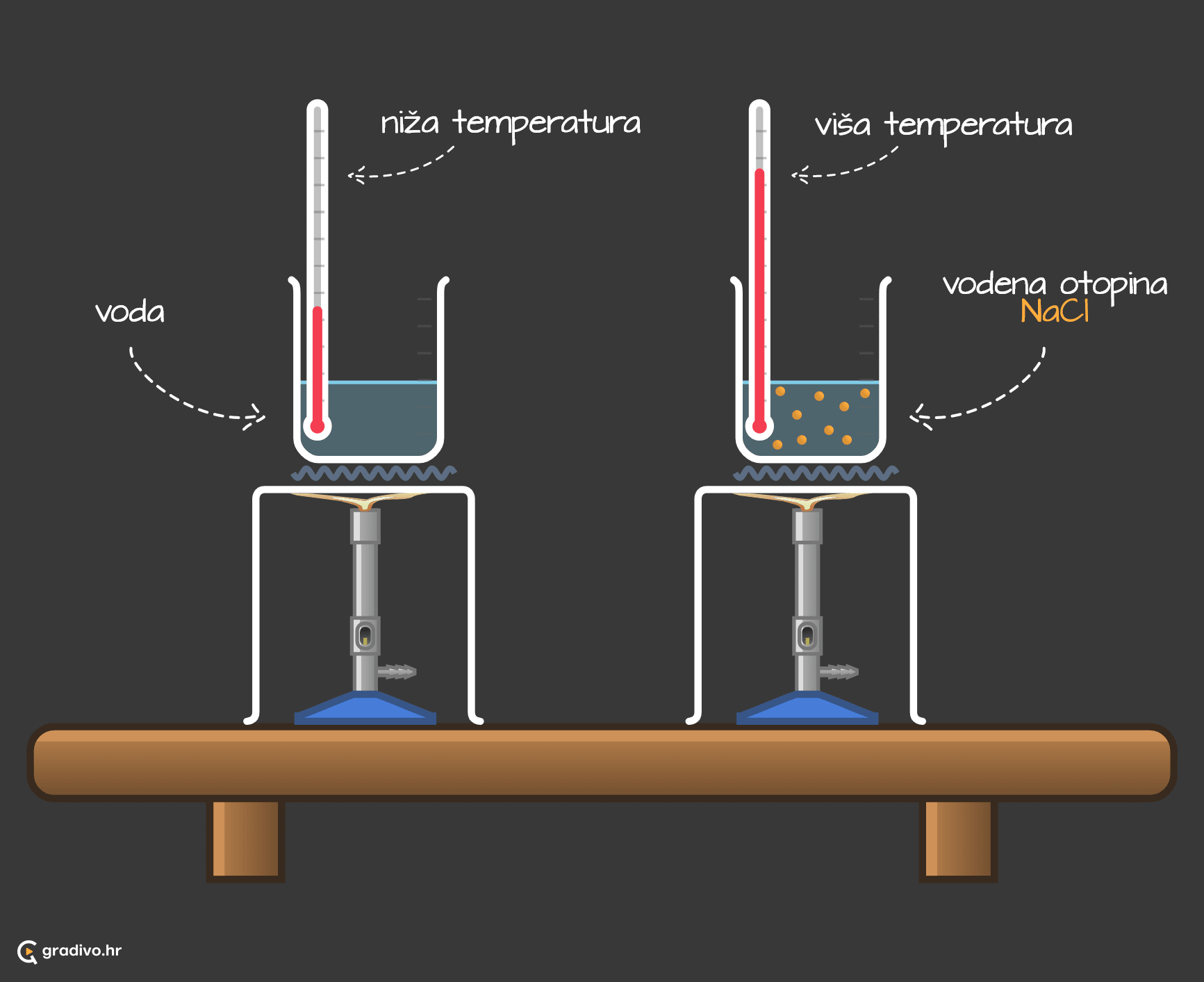
Sniženje ledišta
Otapanjem tvari u tekućinama
Kako bi se zimi spriječilo stvaranje poledice na cestama i kolnicima, oni se posipaju solju. Također, U sustave za hlađenje motora automobila ulijeva se etilen-glikol (antifriz) kako bi se spriječilo zaleđivanje tekućine za hlađenje.
Ledište otopine uvijek je niže od ledišta otapala. To se lako može vizualizirati na prikazu faznih dijagrama čiste vode i vodene otopine natrijeva klorida.
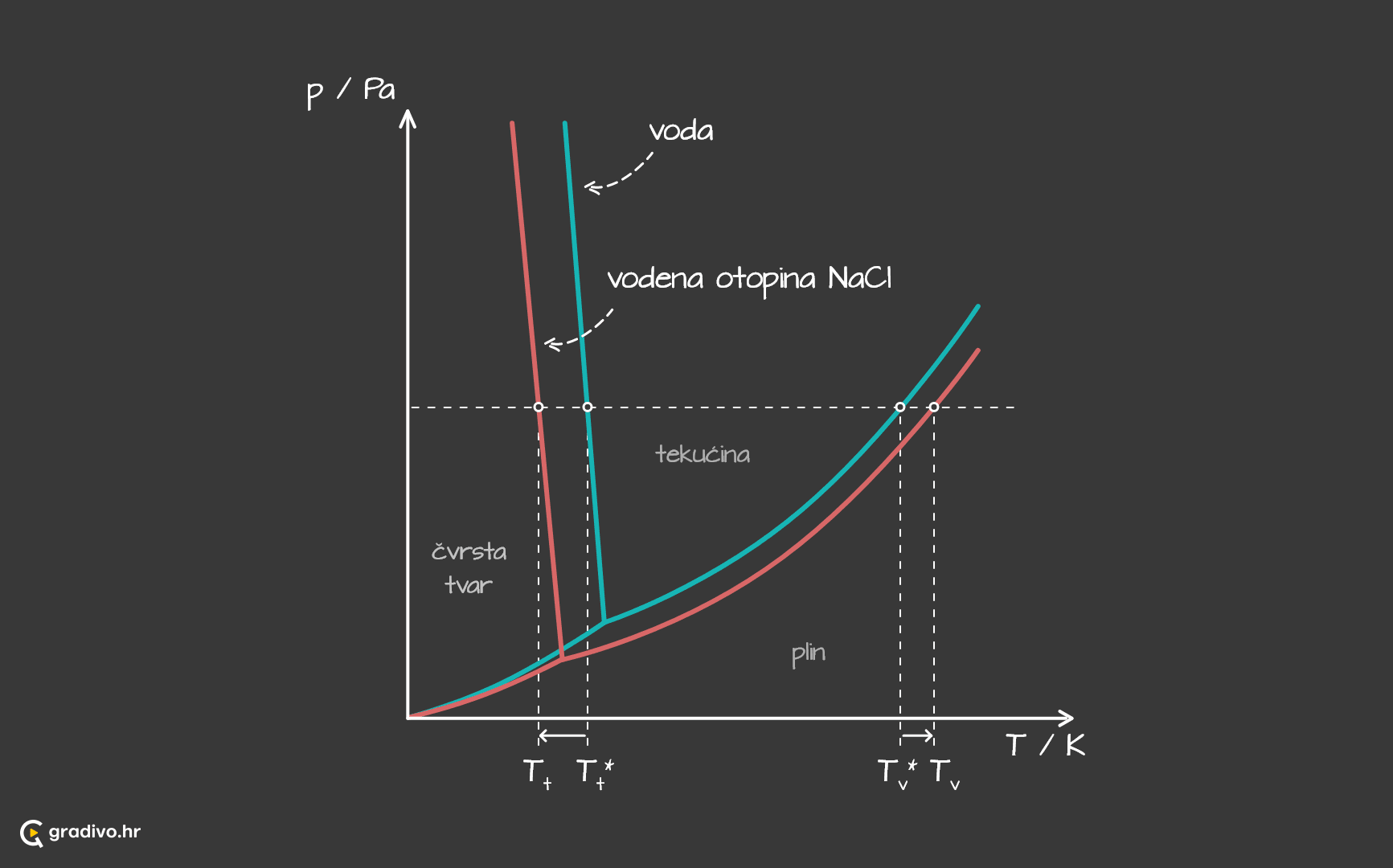
Za koliko stupnjeva će se promjeniti ledište otopine u odnosu na čisto otapalo proučava
gdje je
Osmotski tlak
Osmotski tlak javlja se kao

Osmotski tlak računa se prema formuli:
pri čemu je
Isprobaj potpuno besplatno!
Registracijom dobivaš besplatan*
pristup dijelu lekcija za svaki predmet.