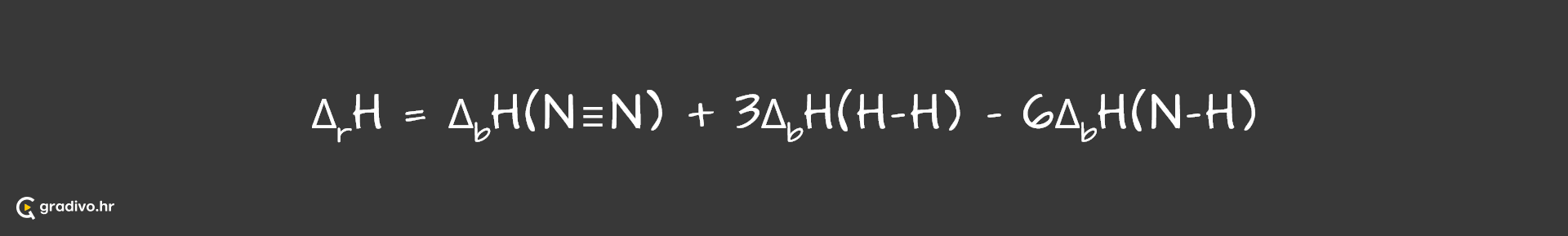Entalpija sustava termodinamička je veličina čija je vrijednost bliska vrijednosti unutarnje energije sustava.
$ q=\Delta H \quad(p=\text { konst. }) $
Prenesena toplina pri stalnom tlaku i temperaturi jednaka je promjeni entalpije, označuje se s ΔH, a jedinica je joule (znak J).
Mjereći promjenu entalpije sustava možemo donositi zaključke o promjeni unutarnje energije sustava.
Entalpijski dijagram je shematski prikaz promjene entalpije sustava tijekom nekog procesa. Vodoravne linije označuju entalpije početnog i konačnog stanja, a uspravne strelice prijelaze iz jednog stanja u drugo.
Kod egzotermnih reakcija, promjena entalpije je negativna. Upravo zbog toga će se na entalpijskom dijagramu reaktanti nalaziti iznad produkata, a smjer strelice će biti prema dolje.


Kod endotermnih reakcija, promjena entalpije je pozitivna. Upravo zbog toga će se na entalpijskom dijagramu reaktanti nalaziti ispod produkata, a smjer strelice će biti prema gore.


Eksperimentom možemo odrediti koliko se entalpija promijenila (ΔH).
U prodaji se mogu naći tzv. instant vrećice za hlađenje (engl. instant cold pack) i instant vrećice za grijanje (engl. instant heat pack). Rabe se i za pružanje prve pomoći i za tretiranje sportskih ozljeda, a njihovo se djelovanje temelji na energijskim promjenama tijekom otapanja soli. Primjerice, vrećica za hlađenje sastoji se od dvaju dijelova. U jednom je amonijev klorid, a u drugom voda. Pritisne li se vrećica, opna između pregrada pukne i tvari se pomiješaju. Kako je otapanje amonijeva klorida endoterman proces, vrećica sa smjesom se ohladi. U vrećici za grijanje nalazi se natrijev acetat jer je njegova kristalizacija iz vodene otopine egzoterman proces. Mjerenjem, koliko je topline sustav primio ili dao, možemo odrediti promjenu entalpije.
Molarna entalpija
Molarna entalpija je promjena entalpije podijeljena množinom tvari.
$ H_{\mathrm{m}}=\frac{H}{n} $
Tijekom fizikalne ili kemijske promjene dolazi i do promjene molarne entalpije koja je jednaka razlici molarnih entalpija konačnoga i početnog stanja:
K2.$ \Delta H_{\mathrm{m}}=H_{\mathrm{m}}(2)-H_{\mathrm{m}}(1) $
Promjene molarnih entalpija pojedinih procesa imaju posebne oznake, primjerice taljenje ΔslH, isparavanje ΔlgH, otapanje ΔsolH itd. Indeksima s, I, g i sol želi se istaknuti o kojem je procesu riječ.
Entalpija faznog prijelaza
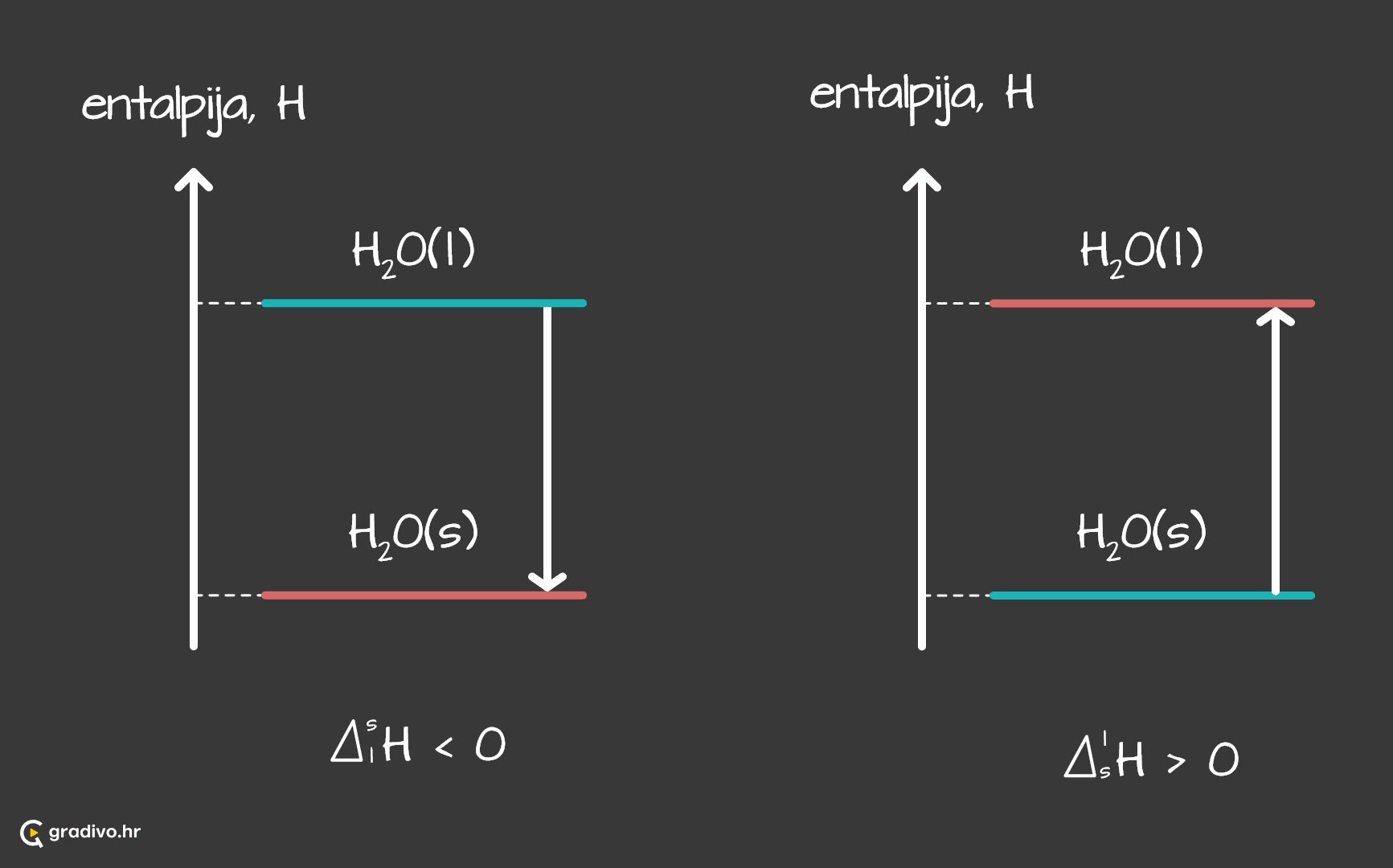
Entalpija faznog prijelaza (ΔprijelazH) je promjena entalpije pri prijelazu iz jednog agregaciiskog stanja u drugo pri stalnome tlaku.
Na primjeru entalpijskih dijagrama očvršćavanja vode (lijevo) i taljenja leda (desno) pokazano je da je promjena entalije takvih suprotnih procesa jednaka po iznosu, a različita po predznaku tj. vrijedi ΔlsH = -ΔslH.

Reakcijska entalpija
Reakcijska entalpija (ΔrH) izmijenjena je toplina pri stalnom tlaku i temperaturi podijeljena množinom reakcijskih pretvorbi.
K2.$ \Delta_r H=\frac{\Delta H}{\Delta \xi} $
Entalpije stvaranja
Entalpija stvaranja (ΔfH) neke tvari je reakcijska entalpija pretvorbe u kojoj ta tvar nastaje iz elementarnih tvari u standardnom stanju.
Standardno stanje tvari je najstabilniji oblik čiste tvari pri tlaku od 100 kPa.
Iz poznatih entalpija stvaranja svih sudionika reakcije (reaktanata i produkata) možemo izračunati entalpiju bilo koje reakcije s pomoću sljedeće formule:
$ \Delta_{\mathrm{r}} H^{\circ}=\sum v_{\mathrm{i}} \Delta_{\mathrm{f}} H^{\circ}\left(\text { produkti) }+\sum v_{\mathrm{i}} \Delta_{\mathrm{f}} H^{\circ}\right. \text { (reaktanti) } $
Pr. Tako na primjeru nastanka etana iz etena i vodika možemo pokazati kako ćemo računati reakcijsku entalpiju iz entalpije nastanka pojedinih sudionika reakcije.


Entalpija sagorijevanja
Entalpija sagorijevanja (ΔcH) promjena je entalpije koja prati potpuno izgaranje uzorka.
Entalpija veze
Entalpija veze (ΔbH) je mjera jakosti kovalentne veze između atoma unutar molekule.
Pr. Moguće je izračunati reakcijsku entalpiju koristeći entalpije veza. Pogledajmo kako se to radi na primjeru nastanka 2 molekule amonijaka iz jedne molekule dušika i 3 molekule vodika.


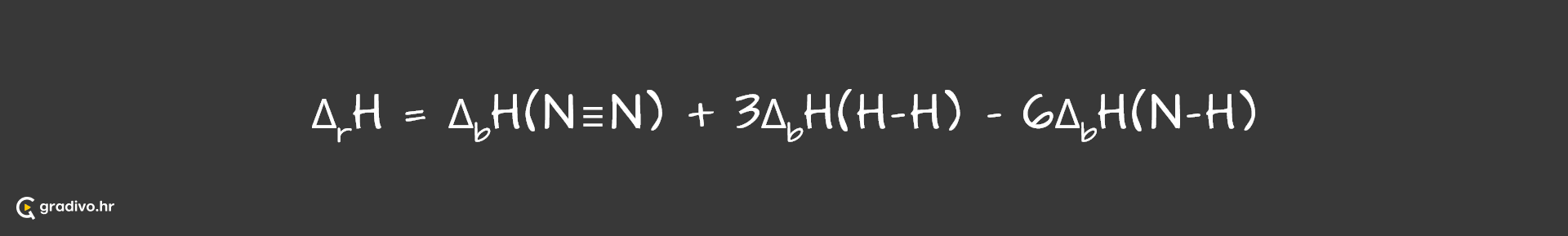

Promjena entalpije tijekom kemijske reakcije određuje se reakcijskim kalorimetrom.