Kemija - 2013./14. ljeto - 6.
Dijagram prikazuje ovisnost množinskih koncentracija sudionika reakcije o vremenu. Volumen je reakcijske smjese .
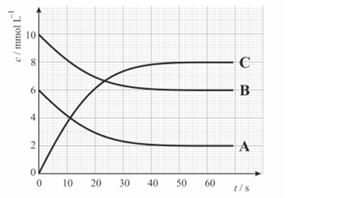
Napišite jednadžbu kemijske reakcije prema prikazanome dijagramu.
Napišite izraz za koncentracijsku konstantu kemijske ravnoteže prikazane dijagramom.
Očitajte s dijagrama vrijeme nakon kojega se u sustavu uspostavi ravnotežno stanje.
Izračunajte množinu tvari B u reakcijskoj smjesi nakon uspostavljanja kemijske ravnoteže.
Izračunajte prosječnu brzinu nastajanja produkta C u prvih 20 s reakcije opisane u zadatku 6.
Kolika je promjena brzine nastajanja produkta u stanju ravnoteže?