Kemija - 2012./13. ljeto - 5.
Dijagram prikazuje promjenu množinskih koncentracija dviju tvari u reakcijskoj smjesi sta volumena u ovisnosti o vremenu t.
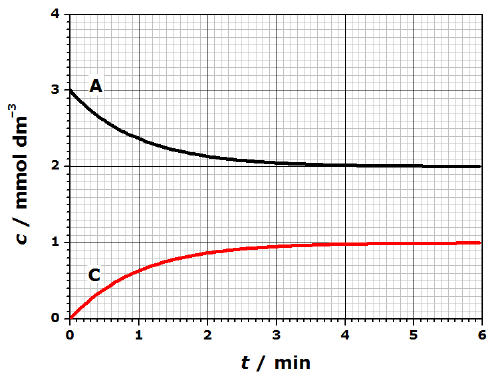
Napišite odgovarajuću jednadžbu kemijske reakcije.
Kada se nakon 5 minuta provedbe kemijske reakcije, za koju je ovisnost koncentracije dviju tvari u rekacijskoj smjesi stalna volumena grafički prikazana u 5. zadatku, uspostavila ravnoteža, dodano je, uz konstantni volumen reakcijske smjese, još tvari C, pri čemu se njezina koncentracija udvostručila 1 na 2 . Kolike će biti koncentracije komponenata reakcije kada se ponovno uspostavi ravnotežno stanje?
Izračunajte srednju brzinu kemijske reakcije tijekom prvih dviju minuta provedbe reakcije koristeći dijagram iz 5. zadatka.
Srednja brzina kemijske reakcije je .