Kemija - 2018. ljeto, 4.
Ionizacija vode može se prikazati ravnotežnom jednadžbom kemijske reakcije
Na dijagramu su prikazane vrijednosti ravnotežnih konstanti ionizacije vode pri različitim temperaturama.
Na dijagramu su prikazane vrijednosti ravnotežnih konstanti ionizacije vode pri različitim temperaturama.
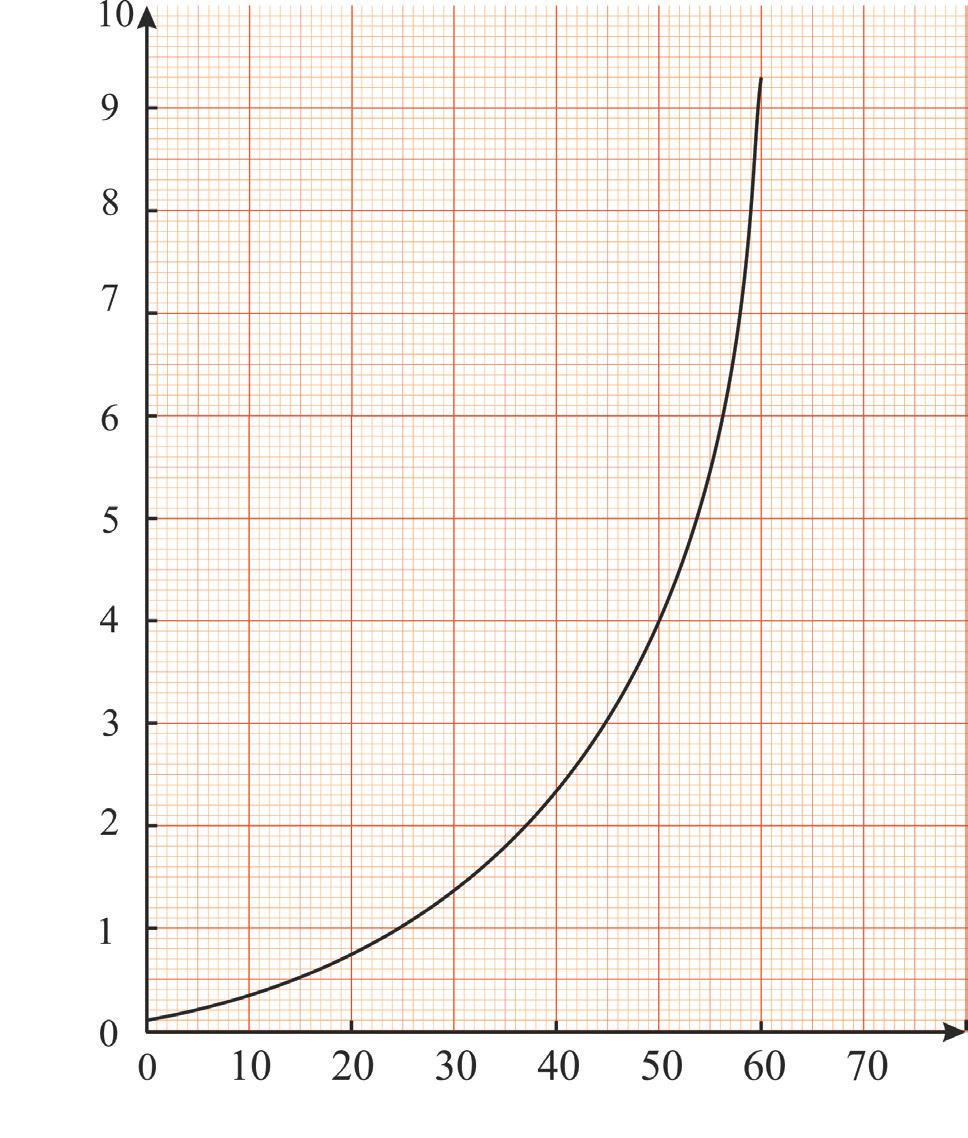
S dijagrama očitajte vrijednost ravnotežne konstante ionskoga produkta vode pri .
Napišite izraz za ravnotežnu konstantu ionizacije vode na temelju jednadžbe kemijske reakcije.
Ravnotežna konstanta ionizacije vode pri iznosi . Koliko iznosi pH-vrijednost čiste vode pri $40^{\circ} \mathrm{C}$ ?
pH =
Koliki je omjer množinskih koncentracija hidroksidnih i oksonijevih iona u čistoj vodi pri ?